-
升高温度时,化学反应速率加快原因的合理解释是
A.该化学反应的过程是吸热的
B.该化学反应的过程是放热的
C.分子运动速率加快,使反应物分子的碰撞机会增多
D.反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多
难度: 简单查看答案及解析
-
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
B.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-11 036 kJ/mol
C.CO(g)+1/2O2(g)=CO2(g) ΔH=-283. 0 kJ/mol
D.C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/mol
难度: 简单查看答案及解析
-
醋酸溶液中滴入稀氨水,溶液的导电能力(用电流I表示)发生变化,其电流I随加人稀氨水的体积V的变化曲线图是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
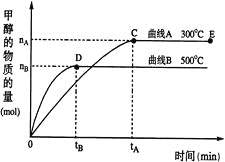
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)+Y(g)
nZ(g)+2W(g),在5 min时已经生成0.2 mol W,若测知以Z的浓度变化表示平均反应速率为0.01 mol·L-1·min-1,则上述反应中Z气体的化学计量数n的值是( )
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1 mol O2和2 mol NO,发生如下反应:O2(g)+2NO(g)
2NO2(g),表明此反应不一定达平衡的是( )
A.容器内O2、NO、NO2的浓度之比为1∶2∶2
B.容器内压强不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间内生成1 mol O2,同时生成2 mol NO2
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是
A.
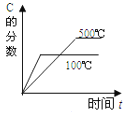
B.
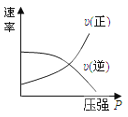
C.
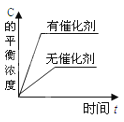
D.

难度: 中等查看答案及解析
-
如图是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线。下列说法正确的是( )
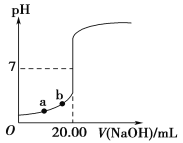
A.指示剂变色时,说明盐酸与NaOH恰好完全反应
B.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3
C.水电离出的氢离子浓度:a>b
D.盐酸的物质的量浓度为0.010 0 mol·L-1
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.铁上镀铜时,可用硫酸铜溶液为电解质溶液,硫酸铜溶液的浓度不变
B.用惰性电极电解饱和的食盐水时,溶液的pH变大
C.金属越活泼,越不容易冶炼,可以用电解氯化钠溶液制备金属钠
D.电解法精炼铜,粗铜为阳极,硫酸铜为电解质溶液,硫酸铜溶液浓度会变小
难度: 简单查看答案及解析
-
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是( )

A.x是正极,y是负极 B.a极产生氢气,b极生成I2
C.a极和Pt电极都有气泡产生 D.U形管中溶液的碱性增强
难度: 中等查看答案及解析
-
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
A.某温度下,测得溶液的pH<7
B.溶液中c(Na+)=c(A2-)
C.溶液中存在Na+、HA-、A2-、H2A多种微粒
D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
难度: 中等查看答案及解析
-
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
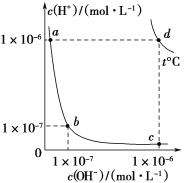
A.d点对应的食盐水pH=6,呈中性
B.a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
C.温度为t ℃时,0.05 mol·L-1 Ba(OH)2溶液的pH=11
D.向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B.将水加热,KW增大,pH不变
C.向水中加入氨水,平衡逆向移动,c(OH-)降低
D.向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低
难度: 简单查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.Na2CO3溶液:K+、Fe3+、SO42-、NO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.无色溶液:Ca2+、H+、Cl-、HSO3-
D.室温下由水电离产生的c(H+)=10-12 mol·L-1的溶液中,一定能大量共存的离子组是:Cl-、SO42-、Na+、K+
难度: 中等查看答案及解析
-
能正确解释下列反应原理的离子方程式是( )
A.用明矾作净水剂:Al3++3H2O
Al(OH)3↓+3H+
B.氯气通入水中,溶液呈酸性:Cl2 + H2O
2H+ + Cl- + ClO-
C.酚酞滴入碳酸钠溶液中,溶液变红:CO32- + 2H2O
H2CO3+ 2OH-
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4 + CO32-=CaCO3 + SO42-
难度: 中等查看答案及解析
-
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下列各图所示内容比较符合客观事实的是
A.
 B.
B. C.
C. D.
D.
难度: 中等查看答案及解析
-
25 ℃时,在10 mL浓度均为0.1 mol·L-1的NaOH和NH3·H2O混合溶液中滴加0.1 mol·L-1盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
B.加入20 mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
C.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
D.加入10 mL盐酸时:c(NH4+)+c(H+)=c(OH-)
难度: 中等查看答案及解析
-
某温度时,AgCl(s)
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.d点没有AgCl沉淀生成
B.c点对应的Ksp等于a点对应的Ksp
C.加入AgNO3,可以使溶液由c点变到d点
D.加入少量水,平衡右移,Cl-浓度减小
难度: 中等查看答案及解析
-
25℃时,几种弱酸的电离常数如下:
酸
CH3COOH
HCN
H2S
电离常数(25℃)
1.8×10-3
4.9×10-10
K1=1.3×10-7
K2=7.1×10-13
下列说法正确的是( )
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度HCN的水溶液的pH=d,则其中c(OH-)=10-dmol/L
难度: 中等查看答案及解析