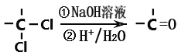-
化学与生活关系非常密切,下列关于生活中的化学叙述正确的是( )
A.金属镁着火后,可以用灭火器中的干粉扑灭
B.玉坠的主要成分是二氧化硅
C.聚乙烯、聚氯乙烯都是高分子材料,对环境的影响是形成白色污染
D.含碘食盐中含有KI,可以预防地方性甲状腺肿大
难度: 简单查看答案及解析
-
将足量Cl2通入FeBr2和NaBr的混合溶液中,反应总的离子方程式为:Fe2+ +3Br-+2Cl2 = Fe3+ +2Br2 + 4Cl-,则混合溶液中FeBr2和NaBr的物质的量的比为( )
A.1:1 B.1:2 C.2:1 D.1:3
难度: 中等查看答案及解析
-
常温下,将足量CO2通入下列饱和溶液中,①Na2CO3溶液②CaCl2溶液③Ba(OH)2溶液④NaAlO2溶液⑤NaCl和NH3的混合溶液,最终溶液变浑浊的有( )
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤.
难度: 中等查看答案及解析
-
C3H5Cl2Br的同分异构体有( )种
A.8 B.9 C.10 D.11
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.8.4g乙烯和丙烯混合气体中含C-H键个数为1.2NA个
B.盛有NO2的密闭容器在含有NA个氧原子,则NO2的物质的量是0.5mol
C.标准状况下,22.4L二氯甲烷的分子数为NA个
D.电解精炼铜时,若阳极质量减少64g,则阴极得电子数为2NA个
难度: 中等查看答案及解析
-
电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )

A.X为负极,F溶液为NaNO3溶液
B.电解一段时间,往Pt(I)附近滴入酚酞,溶液变红
C.电解的总反应为2H2O
2H2↑ + O2↑
D.理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
难度: 中等查看答案及解析
-
有A、B、C、D、E、F六种短周期主族元素,它们的相对原子质量依次增大,A是元素周期表中原子半径最小的元素,B的最高正价和最低负价的代数和为0,C和E能形成两种二元化合物,且E的原子序数是C的2倍,D分别和C、E、F反应,产物均是常见离子化合物,且它们都能溶于水或能和水反应。下列叙述正确的是( )
A.原子半径D>F>E>B>C>A
B.E和F可以用多种方法判断非金属性的强弱
C.E的氧化物都能使品红溶液褪色,加热后又恢复红色
D.含D和F的化合物溶于水,溶液一定显中性
难度: 中等查看答案及解析