-
化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提。下列实验操作正确的是
A.熄灭酒精灯时,为防止失火要用灯帽盖灭而不用嘴吹灭
B.用托盘天平称量氢氧化钠时,放在称量纸上再称量
C.金属钠着火,应立即使用泡沫灭火器灭火
D.用氢气还原氧化铜时,先加热再通入氢气,可节省氢气的用量
难度: 简单查看答案及解析
-
下列有关物质的性质与用途不具有对应关系的是
A.CaO能与水反应,可用作食品干燥剂
B.ClO2具有较强的氧化性,可作为自来水的消毒剂
C.NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂
D.还原铁粉具有较大的表面积和较强的化学活性,可用作富脂类食品的脱氧剂
难度: 中等查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞箐”的分子(直径为1.3×10﹣8m)恢复了磁性。“钴酞箐”分子的结构和性质与人体内的血红素和植物的叶绿素非常相似。下列关于“钴酞箐”分子的说法中正确的是
A.它在水中所形成的分散系属于乳浊液
B.它的分子既能透过滤纸,也能透过半透膜
C.它在水中形成的分散系与雾的分散系种类相同
D.它的分子直径比Na+小,溶于水后不会形成丁达尔效应
难度: 简单查看答案及解析
-
KClO3 在酸性溶液中可将 VO2+氧化成 VO2+ ,而自身被还原为 Cl-。欲使 3 mol VO2+成 VO2+ ,则需要氧化剂KClO3 的物质的量是( )
A.0.2 mol B.0.5mol C.1 mol D.3mol
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A. HClO的结构式:H-Cl-O
B. 硫原子的原子结构示意图:
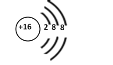
C. 过氧化钠的电子式为:Na+[ :O:: O: ]2-Na+
D. R2+离子核外有a个电子,b个中子,R原子表示为:
难度: 中等查看答案及解析
-
对下列各组物质的分类正确的是
①混合物:钢铁、水银、冰水混合物 ②电解质:胆矾、氯化氢、硫酸钡 ③酸性氧化物:CO、Al2O3、SO2 ④同位素:1H、2H2、3H ⑤同素异形体:C60、金刚石、石墨⑥干冰、液氯都是非电解质
A.①②③④⑤⑥ B.④⑤⑥ C.②⑤ D.②④⑤
难度: 简单查看答案及解析
-
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与硼(5B)同主族,与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素 B.
的中子数与电子数的差值为17
C.原子半径:In>Al D.碱性:In(OH)3>RbOH
难度: 中等查看答案及解析
-
1L 1mol/L NaOH溶液吸收0.8mol CO2,所得溶液中CO32-与HCO3-的物质的量浓度之比为
A.1∶3 B.2∶1 C.2∶3 D.3∶2
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4.0g重水(D2O)中所含质子数为0.4NA
B.4.48L N2与CO的混合物中所含分子数为0.2NA
C.常温下,7.1g Cl2与足量NaOH溶液反应转移的电子数约为0.1NA
D.0.2mol Na2O2中含有离子总数为0.8NA
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、Na+
C.酸性溶液中:Na+、Fe3+、SO42-、Cl-
D.0.1mol/L 的 FeCl3溶液中:Na+、H+、SCN-、I-
难度: 中等查看答案及解析
-
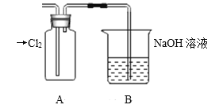
下列有关新制氯水的说法中不正确的是
A.将硝酸银溶液滴到新制氯水中,再加稀硝酸,产生白色沉淀,说明氯水中含有Cl-
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2 有漂白性
C.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明 Cl2 的氧化性强于 I2
D.新制氯水滴到 Na2CO3 溶液中,有气体产生,说明氯水中含有 H+
难度: 中等查看答案及解析
-
如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为 ( )
A. 5x+10 B. 5x C. 5x+14 D. 5x+16
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)
Fe2O3+3H2
难度: 中等查看答案及解析
-
几种短周期元素的主要化合价及原子的原子半径数据见下表:
元素代号
L
M
Q
R
T
主要化合价
+2
+3
+6、﹣2
+7、﹣1
﹣2
原子半径/nm
0.160
0.143
0.102
0.099
0.074
据表中信息判断,下列有关叙述中,正确的是
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.M与T形成的化合物能和强酸、强碱反应且产物不同
C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物
D.L与R两元素形成的化合物中,含有非极性共价键
难度: 困难查看答案及解析