-
下列有关生活和生产中化学知识的描述正确的是( )
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气
C.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
D.自来水厂可用明矾对水进行消毒杀菌
难度: 简单查看答案及解析
-
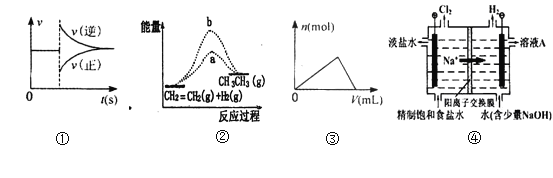
对于实验Ⅰ~Ⅳ的实验现象预测不正确的是( )
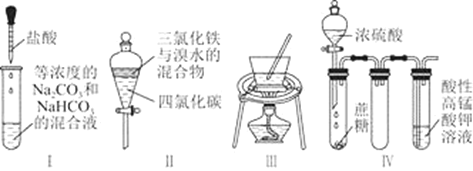
A.实验Ⅲ:从饱和食盐水中提取NaCl晶体
B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层黄色
C.实验Ⅰ:逐滴滴加盐酸时,试管中过一会产生大量气泡
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数的值。下列叙述正确的是( )
A.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
B.标准状况下,11.2LCCl4含有的分子数为0.5NA
C.1molNa被氧化生成Na2O2或NaCl,都失去NA个电子
D.1.0L1.0mol·L-1的NaNO3水溶液中含有的氧原子数为3NA
难度: 中等查看答案及解析
-
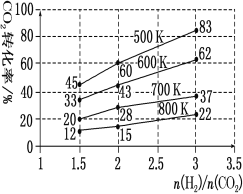
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
C.Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为:Z>Y>W
难度: 中等查看答案及解析
-
下列离子在指定条件下能大量共存的是( )
A.在酸性溶液中:Ba2+、K+、SO42-、Cl-
B.使紫色石蕊变红的溶液中:Na+、I-、NO3-、K+
C.含有大量Al3+的溶液中:K+、Na+、NH4+、SO42-
D.无色溶液中:K+、Cl-、MnO4-、HCO3-
难度: 简单查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知
类推
A
将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+
将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+
B
向Ca(ClO)2溶液中通入少量CO2
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C
用惰性电极电解NaCl溶液
2Cl-+2H2O
2OH-+H2↑+Cl2↑
用惰性电极电解MgBr2溶液
2Br-+2H2O
2OH-+H2↑+Br2
D
稀盐酸与NaOH溶液反应至中性
H++OH-=H2O
稀HNO3与Ba(OH)2溶液反应至中性
H++OH-=H2O
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
选项
物质及其杂质
检验
除杂
A
Cl2(HCl)
湿润的淀粉KI试纸
饱和食盐水
B
NO(NO2)
观察颜色或湿润的淀粉KI试纸
水
C
CO2(HCl)
AgNO3溶液(含稀硝酸)
饱和Na2CO3溶液
D
NaHCO3溶液(Na2CO3)
Ca(OH)2溶液
过量CO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是
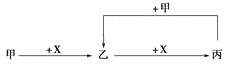
A.甲为C,X为O2
B.甲为SO2,X为NaOH溶液
C.甲为Fe,X为Cl2
D.甲为AlCl3溶液,X为NaOH溶液
难度: 中等查看答案及解析
-
已知下列热化学反应方程式为
H2(g)+
O2(g)=H2O(l) △H1
C(s)+O2(g)=CO2(g) △H2
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H3
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
则△H4的正确表达式为
A. △H3-2△H1-2△H2 B. 2△H1+2△H2-△H3
C. 2△H1-2△H2+△H3 D. 2△H1-2△H2-△H3
难度: 中等查看答案及解析
-
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
(1)
用pH试纸检验
溶液的pH大于7
(2)
向溶液中滴加氯水,再加入CCl4振荡,静置
CCl4层呈橙红色
(3)
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3
有白色沉淀产生
(4)
过滤,向滤液中加入AgNO3溶液和稀HNO3
有白色沉淀产生
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是④③⑥
难度: 中等查看答案及解析
-
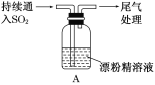
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
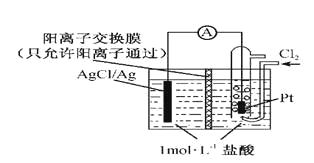
A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析