-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。这种做法的化学原因是
A. 胶体的电泳 B. 胶体的丁达尔效应
C. 胶体的布朗运动 D. 胶体的聚沉
难度: 简单查看答案及解析
-
将一块铝箔用砂纸打磨表面后,在酒精灯上加热至熔化,下列说法正确的是:
A. 熔化的是铝 B. 熔化的是Al2O3 C. 熔化物迅速燃烧 D. 熔化物迅速滴落下来
难度: 简单查看答案及解析
-
为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤,不正确的操作顺序是( )
A. ⑤③①②⑤④ B. ⑤②①③⑤④
C. ⑤②③①⑤④ D. ⑤③②①⑤④
难度: 中等查看答案及解析
-
下列变化中,需要加入氧化剂才能实现的是
A. Cl-→Cl2 B. CuO→Cu C. CaCO3→CO2 D. H2O2→O2
难度: 简单查看答案及解析
-
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Ag B.Cu C.Mg D.H2
难度: 简单查看答案及解析
-
下列分离和提纯的实验操作中,正确的是
A.
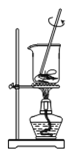 蒸发 B.
蒸发 B. 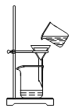 过滤
过滤C.
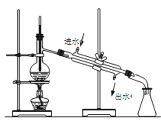 蒸馏 D.
蒸馏 D. 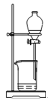 分液
分液难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应的是
A.IBr + H2O = HIO + HBr B.SO3 + H2O = H2SO4
C.SO2 + 2KOH = K2SO3 + H2O D.NaH + H2O = NaOH + H2↑
难度: 简单查看答案及解析
-
根据化学方程式:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A. Br-、Fe2+、I- B. I-、Fe2+、Br-
C. Br2、Fe3+、I2 D. Br-、I-、Fe2+
难度: 简单查看答案及解析
-
在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
A.1:2 B.2:1 C.1:1 D.3:2
难度: 中等查看答案及解析
-
下列行为不符合安全要求的是
A.做实验剩余的金属钠直接丢弃在废液缸中
B.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
C.配制稀硫酸时将浓硫酸慢慢倒入水中并不断搅拌
D.不慎洒出的酒精在桌上着火时,立即用湿毛巾盖灭
难度: 简单查看答案及解析
-
设阿伏伽罗常数的值为NA,标准状况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )
A.
L B.
L C.
L D.
L
难度: 中等查看答案及解析
-
配制250mL0.1mol/L的盐酸溶液时,下列实验操作使配制溶液的浓度偏小的是
A.用量筒量取所需的浓盐酸时俯视刻度线
B.定容时,俯视刻度线
C.用量筒量取所需浓盐酸倒入烧杯后,用水洗涤量筒2~3次,洗涤液倒入烧杯中
D.定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,可以不管它
难度: 中等查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是( )
A.用10mL量筒量取7.36mLNaOH 溶液
B.用托盘天平称取6.85g食盐
C.实验室配置480ml的碳酸钠溶液需要使用500ml容量瓶
D.用广泛pH试纸测得某溶液pH为5.5
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+
B.CO2通入石灰乳中:CO2+Ca2++2OH﹣═CaCO3↓+H2O
C.铁屑溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑
D.向FeBr2溶液中通入足量的Cl2:2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣
难度: 中等查看答案及解析
-
反应3NO2+H2O===2HNO3+NO中,当有6 mol e-发生转移时,被氧化的物质与被还原的物质的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为H2O2<Fe2+<I-<SO2。则下列反应不能发生的是
A.2Fe3++SO2+2H2O
2Fe2++SO42-+4H+ B.H2O2+H2SO4
SO2↑+O2↑+2H2O
C.I2+SO2+2H2O
H2SO4+2HI D.2Fe3++2I-
2Fe2++I2
难度: 中等查看答案及解析
-
氧化还原反应与四种基本反应类型关系如图,下列化学反应属于区域3的是( )

A.Zn+H2SO4 == ZnSO4+ H2 ↑
B.3CO+Fe2O3
2Fe+3CO2
C.CaO+H2O == Ca(OH)2
D.CaCO3
CaO+CO2 ↑
难度: 中等查看答案及解析
-
下列各反应中HCl既不是氧化剂又不是还原剂的是
A.
B.
C.MnO2+4HCl
MnCl2+Cl2↑+2H2O
D.
难度: 简单查看答案及解析
-
在反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,浓硫酸的作用是( )
A.酸性 B.强氧化性 C.酸性和强氧化性 D.还原性
难度: 中等查看答案及解析
-
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
难度: 中等查看答案及解析
-
在烧杯中加入水和煤油(密度:约0.8g•cm﹣3)各50mL。将一小粒金属钠投入该烧杯中(钠的密度:0.97g•cm﹣3)。可能观察到的现象是( )
A.钠在水层中反应并四处游动
B.钠停留在煤油层中不发生反应
C.钠在煤油的液面上反应并四处游动
D.钠在煤油与水的界面处反应并可能作上下跳动
难度: 中等查看答案及解析
-
下列关于金属钠的叙述中,正确的是( )
A.钠着火时应用干燥的沙土灭火
B.为防止钠与水反应时燃烧,可将该反应置于试管中进行,以减少与氧气的接触
C.钠在空气中受热时,熔化为银白色的小球,产生黄色的火焰,生成白色粉末
D.钠在空气中长期放置,最终主要生成物为过氧化钠
难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得甲、乙两烧杯中生成的气体体积之比为2:3,则加入的铝粉质量可能为( )
A.8.1g B.3.6g C.5.4g D.4.05g
难度: 中等查看答案及解析