-
我国太阳能开发利用位于世界前列。下列采用“光——热——电”能量转换形式的是
A.光致(互变异构)储能
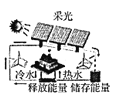
B.生产甲醇燃料
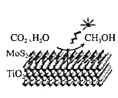
C.太阳能熔盐发电
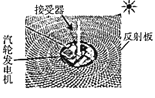
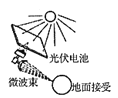
D.太阳能空间发电
难度: 简单查看答案及解析
-
2019年8月《Green Chemistry》报道了我国学者发明的低压高效电催化还原CO2的新方法,其总反应为NaCl+CO2
CO+NaClO。下列有关化学用语表示错误的是( )
A.中子数为12的钠原子:
Na B.Cl-的结构示意图:
C.CO2的结构式:O=C=O D.NaClO的电子式:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.Mg(OH)2具有碱性,可用于制胃酸中和剂
B.H2O2是无色液体,可用作消毒剂
C.FeCl3具有氧化性,可用作净水剂
D.液NH3具有碱性,可用作制冷剂
难度: 中等查看答案及解析
-
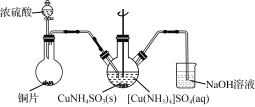
用下列装置制取NH3,并还原CuO,其原理和装置均正确的是( )
A.
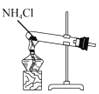 用装置制取NH3 B.
用装置制取NH3 B.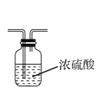 用装置干燥NH3
用装置干燥NH3C.
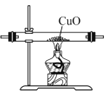 用装置还原CuO D.
用装置还原CuO D.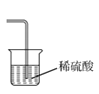 用装置处理尾气
用装置处理尾气难度: 中等查看答案及解析
-
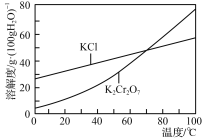
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液:Na+、Ca2+、Br-、HCO3-
B.
=1×10-12的溶液:K+、Na+、CO32-、AlO2-
C.0.1 mol·L-1KFe(SO4)2溶液:Mg2+、Al3+、SCN-、NO3-
D.0.1 mol·L-1Ca5NH4(NO3)11溶液:H+、Fe2+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.铁在热的浓硝酸中钝化 B.CO2与Na2O2反应可产生O2
C.室温下浓硫酸可将石墨氧化为CO2 D.SO2与过量漂白粉浊液反应生成CaSO3
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.SO2与过量氨水反应:SO2+NH3·H2O=NH4++HSO3-
B.FeCl3溶液与SnCl2溶液反应:Fe3++Sn2+=Fe2++Sn4+
C.Cu与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.用浓盐酸与MnO2制取少量Cl2:MnO2+4H++4Cl-
MnCl2+Cl2↑+2H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X位于ⅦA族,Y的原子核外最外层与次外层电子数之和为9,Z是地壳中含量最多的金属元素,W与X同主族。下列说法错误的是( )
A.原子半径:r(Y)>r(Z)>r(W)>r(X)
B.由X、Y组成的化合物是离子化合物
C.X的简单气态氢化物的热稳定性比W的强
D.Y的最高价氧化物对应水化物的碱性比Z的弱
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Al2O3(熔融)
Al(s)
AlCl3(s)
B.FeS2(s)
SO2(g)
H2SO4(aq)
C.NH3(g)
NO(g)
NaNO3(aq)
D.SiO2(s)
H4SiO4(s)
Na2SiO3(aq)
难度: 中等查看答案及解析
-
2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
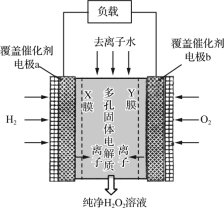
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.碳素钢在海水中发生的腐蚀主要是析氢腐蚀
B.反应Si(s)+2Cl2(g)===SiCl4 (l) 在室温下能自发进行,则该反应的ΔH>0,△S>0
C.室温时,CaCO3在0.1 mol·L-1 的NH4Cl溶液中的溶解度比在纯水中的大
D.2 mol SO2和1 mol O2在密闭容器中混合充分反应,转移电子的数目为4×6.02×1023
难度: 中等查看答案及解析
-
铁杉脂素是重要的木脂素类化合物,其结构简式如右图所示。下列有关铁杉脂素的说法错误的是( )
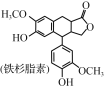
A.分子中两个苯环处于同一平面
B.分子中有3个手性碳原子
C.能与浓溴水发生取代反应
D.1 mol铁杉脂素与NaOH溶液反应最多消耗3 mol NaOH
难度: 中等查看答案及解析
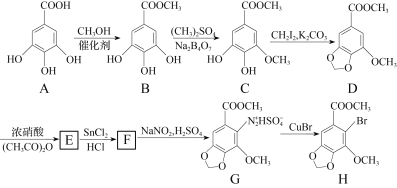
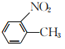 或
或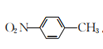 。写出以
。写出以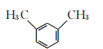 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备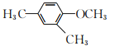 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________________________