-
将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。椐图回答:
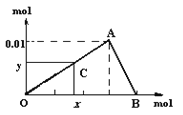
(1)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是________________,由此可得A点的坐标为_______;
(2)当C点从A点向B点运动时,表示:_____。AB曲线表示的离子反应为:______,由此可得B点的坐标为:__________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
-
铅的单质、氧化物、盐在现代工业中有着重要用途。
(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,其反应的化学方程式为_______。
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
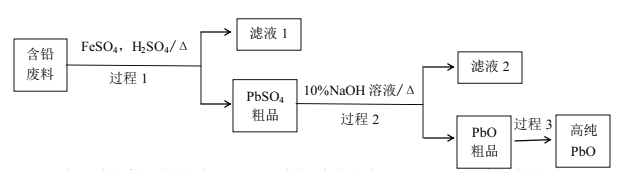
过程1中分离提纯的方法是___,滤液2中的溶质主要是____填物质的名称)。过程1中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
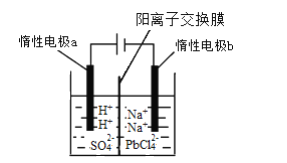
①写出电解时阴极的电极反应式_________。
②电解过程中通过阳离子交换膜的离子主要为____。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向____极室(填“阴”或者“阳”)加入____(填化学式)。
-
二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
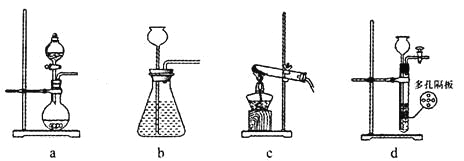
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。
(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
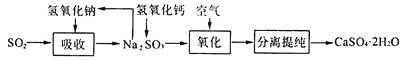
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
-
镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________,未成对电子数为________________。
(2)Ga(NO3)3中阴离子的立体构型是_____________,写出一个与该阴离子的立体构型相同的分子的化学式___________。
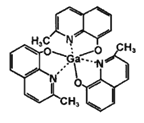
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________(填元素符号),提供孤电子对的成键原子是_____________。
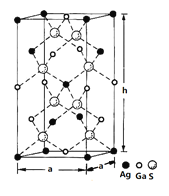
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________g·cm-3(列出计算式即可)。
-
中药丹参中存在丹参醇。一种人工合成丹参醇的部分路线如下:
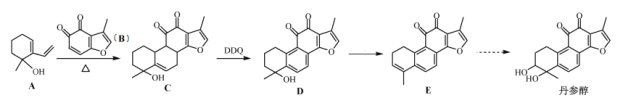
已知:
完成下列填空:
(1)A中官能团的名称:__________________。
(2)D→E的反应条件:___________________。
(3)A和B生成C的反应类型是:______反应。
(4)在铜做催化剂、加热条件下,1mol丹参醇能被_____molO2氧化。
(5)B的分子式是:C9H6O3。符合下列条件的B的同分异构体有__种,写出其中能发生银镜反应的同分异构体的结构简式_____。
①苯环上直接连有一个—OH
②—OH对位上还有一个侧链,该侧链含:—C C—、—COO—。
C—、—COO—。
(6)利用已知条件,写出以 和
和 为原料制备
为原料制备 的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲
的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲 乙
乙
 目标产物)。_____________
目标产物)。_____________
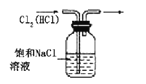 B.实验室制氨气
B.实验室制氨气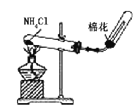 C.制取并收集氯化氢
C.制取并收集氯化氢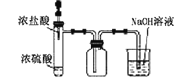 D.证明乙醇发生消去反应生成了乙烯
D.证明乙醇发生消去反应生成了乙烯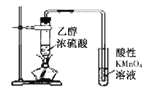
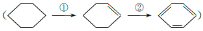 ,下列有关说法正确的是
,下列有关说法正确的是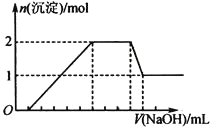
2/9







