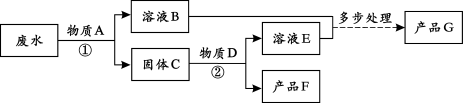
-
下列变化中,属于化学变化的是
A.矿石粉碎 B.纸张燃烧 C.酒精挥发 D.冰雪融化
难度: 中等查看答案及解析
-
下列属于纯净物的是
A.生铁 B.矿泉水 C.硬水 D.蒸馏水
难度: 困难查看答案及解析
-
决定元素种类的是
A.电子数 B.质子数 C.中子数 D.最外层电子数
难度: 中等查看答案及解析
-
地壳中含量最多的金属元素是
A.氧 B.硅 C.铝 D.铁
难度: 中等查看答案及解析
-
空气成分中,体积分数最大的是
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
难度: 简单查看答案及解析
-
下列符号能表示两个氧分子的是
A.O2 B.2O C.2O2 D.2O2-
难度: 中等查看答案及解析
-
工业冶炼金属铝的原理是2Al2O3=4Al+3O2↑,该反应属于
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
难度: 困难查看答案及解析
-
下列物质中,能用作钾肥的是
A.K2SO4 B.CO(NH2)2 C.NH4NO3 D.Ca(H2PO4)2
难度: 中等查看答案及解析
-
下列物品所使用的主要材料属于有机合成材料的是
A.塑料瓶 B.纯棉衣服 C.陶瓷盘 D.羊毛围巾
难度: 困难查看答案及解析
-
下列物质放入水中,能形成溶液的是
A.面粉 B.牛奶 C.食盐 D.植物油
难度: 中等查看答案及解析
-
下列物质的用途中,只利用其物理性质的是
A.氧气用于切割金属
B.干冰用于人工降雨
C.铁粉用作食品保鲜吸氧剂
D.小苏打用于治疗胃酸过多
难度: 中等查看答案及解析
-
下列化学方程式书写正确的是
A.2P + 5O2=P2O5
B.2NaOH + H2SO4=Na2SO4 + H2O
C.CO2 + Ca(OH)2=CaCO3↓+H2O
D.2Fe + 6HCl=FeCl3 + 3H2↑
难度: 中等查看答案及解析
-
下列方法能鉴别空气、氧气和二氧化碳三瓶气体的是
A.闻气味 B.将集气瓶倒扣在水中
C.观察颜色 D.将燃着的木条伸入瓶中
难度: 中等查看答案及解析
-
下列物质置于空气中,一段时间后,质量减小的是
A.浓硫酸 B.氯化钠 C.浓盐酸 D.氢氧化钠
难度: 中等查看答案及解析
-
下列是人体中几种体液的正常pH,酸性最强的是
A.胆汁(6.8~7.4)
B.唾液(6.6~7.1)
C.血液(7.35~7.45)
D.胃液(0.8~1.5)
难度: 中等查看答案及解析
-
“碧螺春”茶叶中的单宁酸具有抑制血压上升、清热解毒、抗癌等功效,其化学式为C76H52O46。下列说法错误的是
A.单宁酸由碳、氢、氧三种元素组成
B.一个单宁酸分子是由76个碳原子、52个氢原子和46个氧原子构成
C.单宁酸中碳、氧元素的质量比为57∶23
D.单宁酸中氢元素的质量分数最小
难度: 中等查看答案及解析
-
在一密闭容器中加入甲、乙、丙、丁四种物质,在下定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示。下列说法中不正确的是
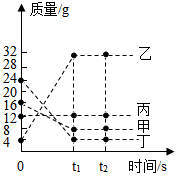
A.该反应为化合反应
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7:5
D.该反应中,甲、乙的质量变化之比为1:4
难度: 困难查看答案及解析
-
20℃时,将等质量不含结晶水的甲、乙固体分别加入到盛有100 g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法错误的是
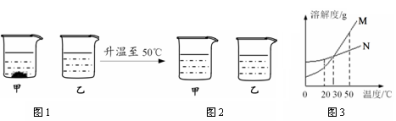
A.图1中,甲一定是饱和溶液
B.图2中,两溶液中溶质的质量分数一定相等
C.图3中,N表示甲的溶解度曲线
D.图2中,两溶液降温至30℃一定都不会析出晶体
难度: 困难查看答案及解析
-
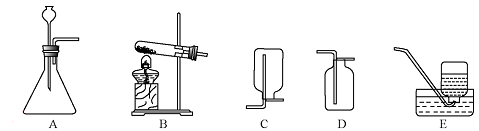
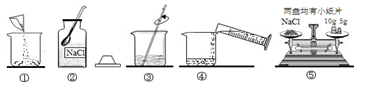
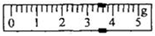
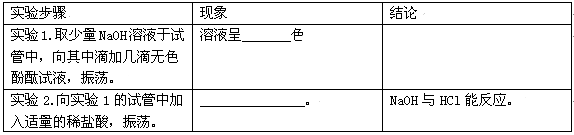
下列实验方案中,能达到实验目的的是

难度: 困难查看答案及解析
-
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示。下列说法正确的是
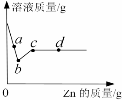
A.取a点溶液,溶质为Zn(NO3)2 和Cu(NO3)2
B.c点溶液中溶质为Zn(NO3)2
C.若取b~c段固体,滴加稀盐酸,有气泡产生
D.取d点的固体有2种
难度: 困难查看答案及解析
-
金鱼洗涤灵主要成分是十八烷基硫酸钠(C18H37OSO3Na),食醋中含有醋酸(CH3COOH)。下列属于有机物的是_______。
A.C18H37OSO3Na B.CH3COOH C.CO2 D.Na2CO3
难度: 中等查看答案及解析
-
甲和乙在一定条件下反应生成丙和丁,微观示意图如下:
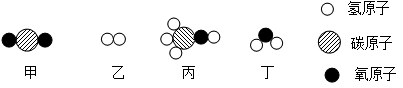
请回答下列问题
(1)丙的相对分子质量为 。
(2)属于氧化物的是 [填序号]。
(3)该反应中参加反应的甲和乙的质量比为 。
难度: 中等查看答案及解析