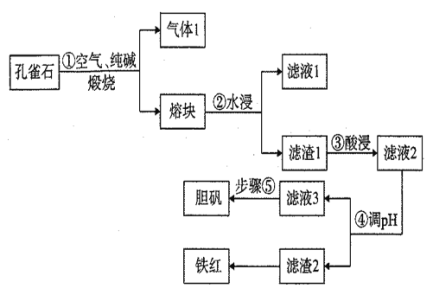
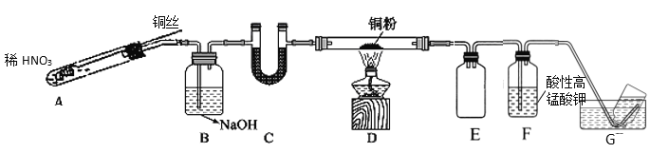
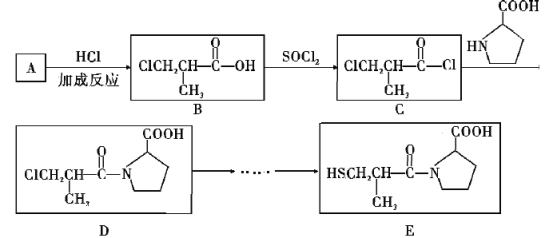
-
用NA代表阿伏加德罗常数的数值。下列说法正确的是
A.3.6 g CaO2晶体中阴离子的数目为0.1NA
B.将7.1 g Cl2通入水中,转移电子数为0.1NA
C.标准状况下,11.2 L O2和CO2混合气体含有的氧原子数为NA
D.室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
用硫酸酸化的H2O2溶液滴入到Fe(NO3)2溶液中,
溶液变成黄色
氧化性: H2O2强于Fe3+
B
蘸有浓氨水的玻璃棒靠近某溶液
有白烟产生
该溶液可能是浓盐酸
C
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
该溶液含钠元素不含钾元素
D
分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫
溶液颜色都变浅
说明氯气和二氧化硫都有漂白性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
废电池投入的垃圾桶上应贴有的垃圾分类标志是( )
A.有害垃圾
 B.可回收物
B.可回收物 
C.餐厨垃圾
 D.其它垃圾
D.其它垃圾 
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.碳酸钠的水溶液呈碱性:
B.用
溶解
:
C.向
胶体中加入氢碘酸溶液:
D.氯化亚铁溶液中通入氯气:
难度: 中等查看答案及解析
-
某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为( )
A. 0.80 B. 0.85 C. 0.90 D. 0.93
难度: 中等查看答案及解析
-
工业上,通常采用电解法处理酸性废水中的
,装置示意图如图所示。下列说法正确的是
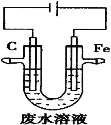
A.石墨极上发生氧化反应
B.阳极的电极反应式为
C.除去
的反应:
D.随着电解的进行,石墨极附近电解质溶液的pH会减小
难度: 简单查看答案及解析
-
常温下某一元碱
溶液与0.01mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7。下列说法中正确的是( )
①反应前,0.01mol/L的一元强酸HA溶液中水电离出的
的浓度为
②反应前,一元碱
其溶液中溶质物质的量浓度一定大于0.01mol/L
③反应后,溶液中离子浓度大小排列顺序一定是c(B+)=c(A-)>c(H+)=c(OH-)
④反应后,混合溶液中HA与A-的浓度总和等于0.01mo/L
A.①② B.①③ C.②④ D.①②④
难度: 中等查看答案及解析