-
垃圾分类有利于资源回收利用。下列垃圾的归类不合理的是
A
B
C
D
垃圾


归类




A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列用离子方程式表示的原理中,正确的是
A.用水除去NO气体中的NO2:3NO2+H2O=2H++2NO3-+NO
B.用碳酸钙与稀盐酸制取CO2:CO32- +2H+=H2O+CO2↑
C.用稀硝酸溶解银:Ag+
+2H+=Ag++NO2↑+H2O
D.用明矾作净水剂:Al3++3H2O=Al(OH)3 ↓+3H+
难度: 中等查看答案及解析
-
锗(32Ge)与钾(19K)同周期。下列说法正确的是
A.锗位于第四周期第ⅤA族 B.
的中子数与电子数的差值为38
C.锗是一种半导体材料 D.碱性:Ge(OH)4>KOH
难度: 简单查看答案及解析
-
下列关于钠及其化合物的叙述不正确的是
A.钠与水反应放出热量
B.Na2O与Na2O2均能与水反应生成NaOH
C.钠切开后,光亮的表面迅速变暗,是因为生成了Na2O2
D.用加热的方法可除去Na2CO3粉末中含有的少量NaHCO3
难度: 简单查看答案及解析
-
有机物X是医药合成的中间体,其结构如下。
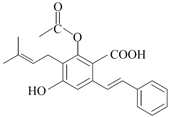
下列说法不正确的是
A.X分子存在顺反异构体 B.X分子中含有3个甲基
C.X分子中含有羧基、羟基和酯基 D.1mol X最多能与2mol NaOH发生反应
难度: 中等查看答案及解析
-
对室温下pH相同、体积相同的氨水与氢氧化钠两种稀溶液,分别采取下列措施,有关叙述正确的是
A.温度均升高20℃,两溶液的pH均不变
B.加入适量氯化铵固体后,两溶液的pH均减小
C.加水稀释100倍后,氨水中c(OH-)比氢氧化钠溶液中的小
D.与足量的氯化铁溶液反应,产生的氢氧化铁沉淀一样多
难度: 中等查看答案及解析
-
铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、稀盐酸和水洗涤。下列说法不正确的是

A.稀盐酸的主要作用是除去铁锈
B.a接电源正极,b接电源负极
C.电镀过程中c(Cu2+)基本保持不变
D.阴极发生反应:Cu2++2e– = Cu
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A
鉴别苯和溴乙烷
取少量苯和溴乙烷,分别加入水
B
除去二氧化碳中的氯化氢
将气体通入碳酸钠溶液中
C
比较氯和硅的非金属性强弱
将盐酸滴入Na2SiO3溶液中
D
验证在酸作用下,蔗糖水解能否生成葡萄糖
取水解后的液体,加入新制的氢氧化铜加热
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用NaOH溶液清洗试管壁上的硫,发生反应S+NaOH—Na2SO3+Na2S+H2O(未配平)。下列说法不正确的是
A.方程式中含钠元素的化合物均含离子键和共价键
B.生成的Na2SO3 和Na2S的物质的量之比为1 : 2
C.方程式中S和H2O的化学计量数相同
D.清洗之后的废液呈碱性
难度: 中等查看答案及解析
-
某同学制作的燃料电池示意图如下,先闭合K1接通电源一段时间后,再断开K1、闭合K2 时,电流表指针偏转。下列分析正确的是
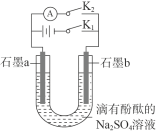
A.闭合K1时,Na2SO4开始电离
B.闭合K1时,石墨a 附近溶液逐渐变红
C.断开K1、闭合K2时,石墨a 附近溶液酸性逐渐减弱
D.断开K1、闭合K2时,石墨b极上发生反应:H2˗2e-=2H+
难度: 中等查看答案及解析
-
乳酸亚铁[(CH3CHOHCOO)2Fe]是一种食品铁强化剂。某同学为检验其中的铁元素设计了如下方案,其中不合理的是
A.向乳酸亚铁溶液中滴加铁氰化钾溶液,出现蓝色沉淀
B.向乳酸亚铁溶液中滴加氢氧化钠溶液,出现灰绿色沉淀
C.向乳酸亚铁溶液中滴加高锰酸钾酸性溶液,振荡后紫色褪去
D.向乳酸亚铁溶液中滴加硫氰化钾溶液,无现象,再加入氯水,溶液变红
难度: 中等查看答案及解析
-
用下图装置探究1-溴丁烷在氢氧化钠溶液中发生的反应,观察到高锰酸钾酸性溶液褪色。下列分析不正确的是

A.推断烧瓶中可能生成了1-丁醇或1-丁烯
B.用红外光谱可检验在该条件下反应生成有机物中的官能团
C.将试管中溶液改为溴水,若溴水褪色,则烧瓶中一定有消去反应发生
D.通过检验反应后烧瓶内溶液中的溴离子,可确定烧瓶内发生的反应类型
难度: 中等查看答案及解析
-
已知:
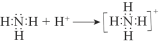 ,所以氨气可看作一元碱。下列关于联氨(N2H4)的推断不正确的是
,所以氨气可看作一元碱。下列关于联氨(N2H4)的推断不正确的是A.结构式为
B.可看作二元碱
C.与过量硫酸反应最终生成N2H6SO4
D.有还原性,在一定条件下可与O2反应生成N2
难度: 简单查看答案及解析
-
根据下列图示所得推论正确的是

A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了HCl和O2
B.乙是C4H10(g)
C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的∆H>0、x>0.1
C.丙是0.5mol/L CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小
D.丁是0.03g镁条分别与2mL 2mol/L盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
难度: 中等查看答案及解析

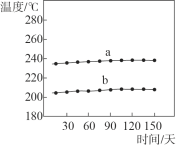
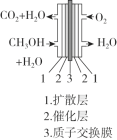
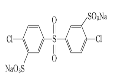 、 _____、___。
、 _____、___。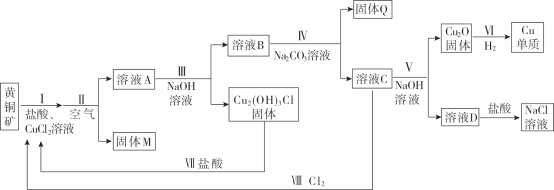
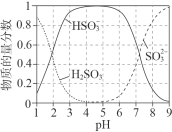
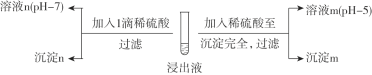
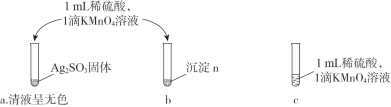




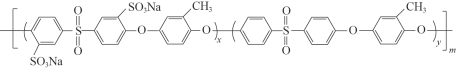
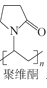 ,依次写出中间体1、Y和中间体2的结构简式:_________。
,依次写出中间体1、Y和中间体2的结构简式:_________。