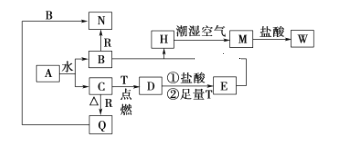
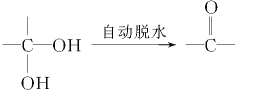
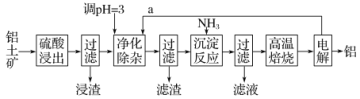
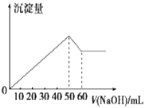
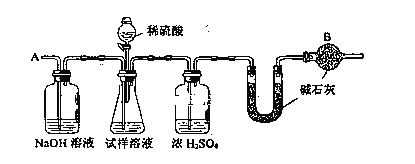
-
向物质的量浓度均为1mol/L的Fe2(SO4)3、CuSO4的1L混合液中加入a mol铁粉,充分反应后,下列说法正确的是( )
A.当a≤1时,发生的反应为Fe+Cu2+=Fe2++Cu
B.当固体有剩余时,溶液中一定存在Fe2+、Cu2+
C.当1≤a<2时,溶液中 n(Fe2+)=(2+a)mol
D.若有固体剩余,则固体中一定有铁,可能有铜
难度: 简单查看答案及解析
-
朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里......月光是隔了树照进来的,高处丛生的灌木,落下参差的斑驳的黑影......”月光穿过薄雾所形成的种种美景的本质原因是( )
A.空气中的小水滴颗粒大小约为10-9m~10-7m
B.光是一种胶体
C.雾是一种胶体
D.发生丁达尔效应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B.0.1mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
C.一定条件下,0.1molSO2与足量氧气反应生成SO3,转移电子数为0.2NA
D.标准状况下,38g3H2O2中含有3NA共价键
难度: 中等查看答案及解析
-
下列对碱金属的叙述,其中完全不正确的组合是 ( )
①K通常保存在煤油中,以隔绝与空气的接触
②碱金属常温下呈固态,取用时可直接用手拿
③碱金属中还原性最强的是钾
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越低
A. ②③⑥ B. ②③④ C. ④⑤⑥ D. ①③⑤
难度: 困难查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
正确; Cl2过量,Fe2+、I-均被氧化
B
Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO
+4OH-=Mg(OH)2 ↓+2CO
+2 H2O
正确;Mg(OH)2比MgCO3更难溶
C
过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO
正确;H2SO3的酸性强于HClO
D
将Na2O2固体溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑
正确; Na2O2是碱性氧化物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图,下列说法正确的是
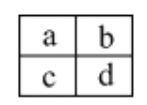
A. a、c两元素的最高正价一定相等
B. 原子半径大小顺序为:c>d>b>a
C. a、b两元素可能形成多种共价化合物
D. c、d二种元素气态氢化物的稳定性比较:c > d
难度: 中等查看答案及解析