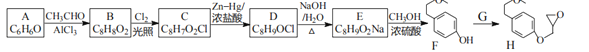-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A.“华为麒麟 980”手机芯片的主要成分是二氧化硅
B.高铁“复兴号”车厢连接关键部位所使用的増强聚四氟乙烯板属于无机髙分子材料
C.公共交通推广使用利用原电池原理制成的太阳能电池汽车,减少化石能源的使用
D.用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提髙空气质量
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L 氟化氢所含分子数为0.1NA
B.常温下,22.4 L 氯气与足量镁粉充分反应,转移的电子数为 2NA
C.丙烯和环丙烷组成的 42 g 混合气体分子中共用电子对总数为 9NA
D.化学反应中每生成 1 mol O2,转移的电子数为 4NA
难度: 中等查看答案及解析
-
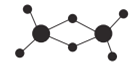
乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )

A.分子式为C6H6O6
B.乌头酸能发生水解反应和加成反应
C.乌头酸能使酸性高锰酸钾溶液褪色
D.含1 mol乌头酸的溶液最多可消耗 3 mol NaOH
难度: 中等查看答案及解析
-
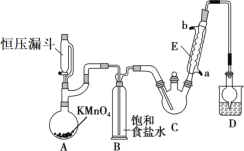
下列实验操作能达到实验目的的是
A.将SO2通入紫色石蕊试液中以检验SO2的酸性和漂白性
B.用玻璃棒蘸取30%双氧水点在 pH 试纸上,再与标准比色卡比较,可测出其pH
C.配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中再加水稀释
D.用饱和NaHSO3溶液吸收尾气中的SO2
难度: 中等查看答案及解析
-
有机化合物甲与乙在一定条件下可反应生成丙:
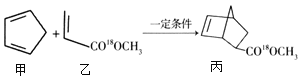
下列说法正确的是
A.甲与乙生成丙的反应属于取代反应
B.甲分子中所有原子共平面
C.乙的一氯代物有2种
D.丙在酸性条件下水解生成
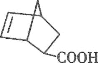 和CH318OH
和CH318OH难度: 中等查看答案及解析
-
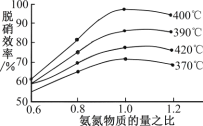
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。 Y是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子总数的3/5。下列说法中一定正确的是( )
A. X的简单气态氢化物稳定性比Z的强
B. 原子半径大小顺序:W<X<Y<Z
C. W的氧化物对应水化物为强酸,具有强氧化性
D. 工业上一般采取电解Y的熔融氯化物来生产Y的单质
难度: 中等查看答案及解析
-
下列有关实验的图示及分析均正确的是
选项
实验目的
实验图示
实验分析
A
实验室用酸性高锰酸钾溶液滴定草酸溶液

摇瓶时,使溶液向一个方向做圆周运动,勿使瓶口接触滴定管,溶液也不得溅出。
B
石油分馏时接收馏出物
为收集到不同沸点范围的馏出物,需要不断更换锥形瓶。
C
测定锌与稀硫酸反应生成氢气的速率
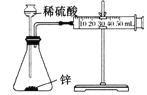
实验中,需测定的物理量是反应时间和生成氢气的体积。
D
用四氯化碳萃取碘水中的碘
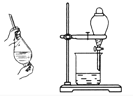
充分振荡后静置,待溶液分层后,先把上层液体从上口倒出,再让下层液体从下口流出。
A.A B.B C.C D.D
难度: 中等查看答案及解析