-
将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为25.4g。若HNO3的还原产物仅为NO,则生成NO的标准状况下的体积为( )
A. 2.24L B. 4.48L C. 6.72L D. 8.96L
难度: 困难查看答案及解析
-
下列有关叙述不正确的是( )
A.为方便运输可用钢瓶储存液氯和浓硫酸
B.能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能
C.钛合金主要用于制作飞机发动机部件,工业上可用钠与四氯化钛溶液反应制取
D.化石燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,现有下列化学用语:①Cl-的结构示意图:
;②羟基的电子式:
;③HClO的结构式:H—Cl—O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-;⑤CO2的比例模型:
;⑥原子核内有10个中子的氧原子:188O。其中说法正确的是( )
A.①④⑤⑥ B.①②⑥ C.①②③⑥ D.②③⑤⑥
难度: 中等查看答案及解析
-
下列物质或离子的检验,叙述正确的是( )
A.用丁达尔效应可鉴别肥皂水和葡萄糖溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.在溶液中加盐酸酸化的 BaCl2 溶液,溶液出现白色沉淀,证明该溶液中有 SO4 2-
D.在溶液中滴加浓氢氧化钠溶液并加热,若产生能使湿润的蓝色石蕊试纸变红的气体,证明该溶液中有 NH4+
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L CH4 中所含共价键数目为2 NA
B.Na2O2 与CO2 反应时,生成0.1 mol O2 时转移电子数目为0.4 NA
C.28 g 由CO 和N2 组成的混合气体中所含质子数为14 NA
D.密闭容器中,2 mol NO与1 mol O2 充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
下列反应的离子方程式中正确的是
A.镁加入过量的稀硝酸:
B.把
投入浓盐酸中:
C.过量的
溶液与
溶液反应:
D.向氯化钡溶液中通入氨气饱和后再通入适量二氧化硫气体,生成白色沉淀
难度: 中等查看答案及解析
-
CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:
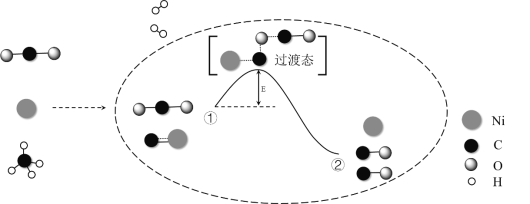
下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
难度: 困难查看答案及解析
-
下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项
实验操作
实验目的或结论
A
室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解且有无色无味气体产生
验证Ksp(BaSO4)<Ksp(BaCO3)
B
将混有Ca(OH)2杂质的Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。
除去Mg(OH)2样品中Ca(OH)2杂质
C
向某黄色溶液中加入淀粉KI溶液,溶液变为蓝色
该溶液中含Br2
D
室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5
HSO3-结合H+的能力比SO32-的强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”
假设盐分以一个NaCl计
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
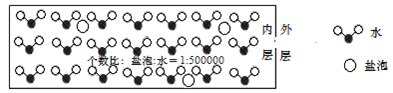
A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为
设冰的密度为
难度: 中等查看答案及解析
-
已知
、
、
、
为原子序数依次增大的短周期元素,
为地壳中含量最高的过渡金属元素,
与
同主族,
与
同周期,且
与
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
A.
、
形成的一种化合物具有漂白性
B.
、
形成的离子化合物可能含有非极性键
C.
的单质能与丙反应置换出
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
难度: 中等查看答案及解析
-
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列说法正确的是( )
A.稀释酸溶液,溶液中所有离子的浓度均减小
B.pH=3 的醋酸溶液与pH=11 的氢氧化钠溶液等体积混合,混合液呈碱性
C.用 CH3COOH 溶液做导电性实验,灯泡很暗,说明 CH3COOH 是弱电解质
D.相同物质的量浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液 pH:盐酸<醋酸
难度: 中等查看答案及解析
-
在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g)
N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
容器(温度)
0min
40min
80min
120min
160min
甲(400℃)
c(NO)
2.00 mol/ L
1.50 mol/ L
1.10 mol/ L
0.80 mol/ L
0.80 mol/ L
乙(400℃)
c(NO)
1.00 mol/ L
0.80 mol/ L
0.65 mol/ L
0.53 mol/ L
0.45 mol/ L
丙(T℃)
c(NO)
2.00 mol/ L
1.40 mol/ L
1.10 mol/ L
1.10 mol/ L
1.10 mol/ L
A.达到平衡状态时,2v正(NO)= v逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为v(NO) >0.01125 mol·L-1·min-1
D.由表格数据可知:T<400℃
难度: 中等查看答案及解析
-
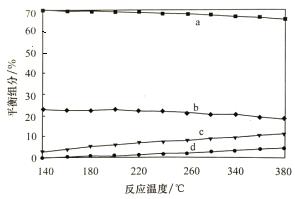
利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)
CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示,下列说法正确的是( )
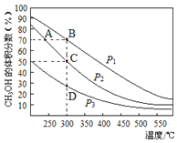
A.该反应的△H<0,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:ν逆(状态A)>ν逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,达平衡时CH3OH的体积分数增大
难度: 困难查看答案及解析
-
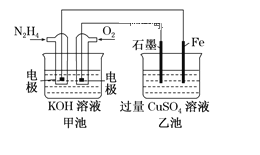
一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
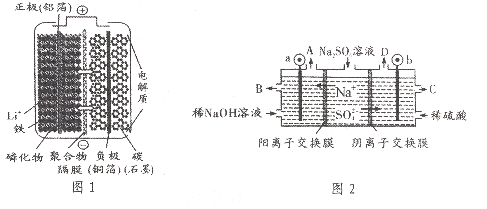
A.电池放电时,LixC6在负极发生氧化反应
B.电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C.电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D.电解时,当转移0.2mol电子,A口产生气体的质量1.6g
难度: 困难查看答案及解析
-
《Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是
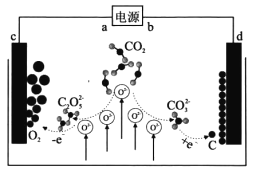
A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e−=C+3O2−
D. 转移lmol电子可捕获CO2 11.2L(标况下)
难度: 中等查看答案及解析