-
化学与生产、生活息息相关,下列说法正确的是( )
A.变质的植物油有难闻的特殊气味,是由于植物油发生了加成反应
B.硅胶可作瓶装药品的干燥剂及催化剂载体,也是重要的半导体材料
C.次氯酸具有强氧化性,所以漂粉精可用于游泳池消毒
D.绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.7.8gNa2O2固体中阴阳离子总数为0.4NA
B.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
C.1.8gD2O中含有的中子数为NA
D.2.24L乙烷中共价键的总数为0.7NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.苯乙烯与氯化氢反应可以生成氯代苯乙烯
B.分子式为C10H14的烃,苯环上只有1个侧链的结构有4种
C.汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O
D.糖类水解的最终产物均为葡萄糖
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.SiO2是酸性氧化物,可溶于强碱(NaOH),不溶于任何酸
B.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.工业上,用焦炭在电炉中还原二氧化硅可得到含杂质的粗硅和CO2
D.向煤中加入适量石灰,使煤燃烧产生的SO2最终生成CaSO4,可减少对大气的污染
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.五彩缤纷的烟花利用了焰色反应,焰色反应是常见的化学反应
B.泡沫灭火器灭火是利用了A12(SO4)3和小苏打的反应
C.Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2
D.实验室可用氧化铝坩埚熔化NaOH、Na2CO3固体
难度: 中等查看答案及解析
-
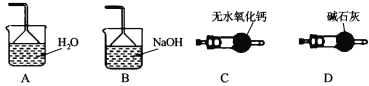
由下列实验及现象得出的结论不正确的是( )
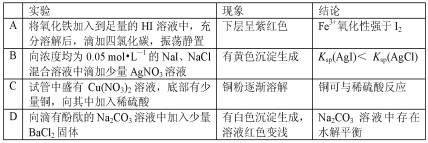
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,非金属元素B的一种单质既是常见的导体,也能用于制作铅笔。D是地壳中含量最高的元素。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。下列说法不正确的是( )
A.在短周期主族元素中,E元素的原子半径最大
B.F的简单氢化物的沸点高于D的简单氢化物沸点
C.A、D、E形成的常见化合物中含有离子键和共价键
D.B和D至少能形成两种化合物
难度: 中等查看答案及解析
-
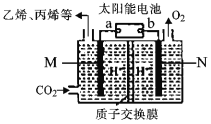
ZulemaBoqas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )

A.负极区是强碱性环境
B.每消耗2.24L(标况)的空气,有0.4mol电子
C.负极反应为:CH3COO-+2H2O-8e- =2CO2↑+7H+
D.Y为阴离子选择性交换膜
难度: 中等查看答案及解析
-
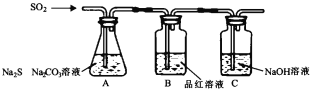
亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )
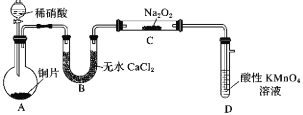
A.可将B中的药品换为浓硫酸
B.实验开始前通一段时间CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A中会有少量红棕色气体
D.装置D中溶液完全褪色后再停止滴加稀硝酸
难度: 中等查看答案及解析
-
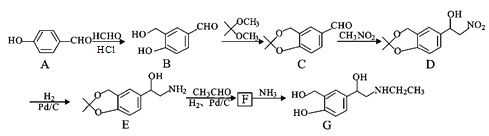
扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( )
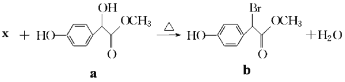
A.物质X是Br2, 物质a转化为b属于取代反应
B.lmol物质a能与3molH2反应,且能在浓硫酸中发生消去反应
C.物质b具有多种能与NaHCO3反应的同分异构体
D.物质b的核磁共振氢谱有四组峰
难度: 中等查看答案及解析
-
某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO3•3H2O)。实验过程如下:
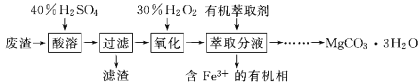
下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
难度: 中等查看答案及解析
-
下列实验装置和操作能达到实验目的的是( )
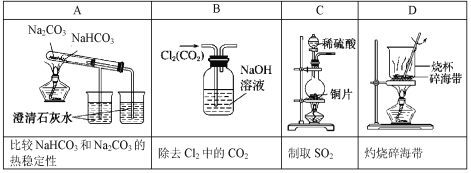
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
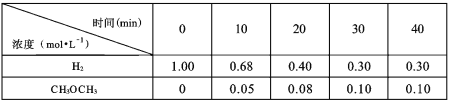
将不同物质的量的M(g)和N(g)分别通入体积为2L的恒容密闭容器中,进行反应M(g)+N(g)
P(g)+Q(g),得到如下两组数据:
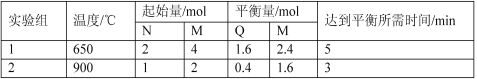
下列说法正确的是( )
A.将实验2的体积压缩为1L,c(Q)为0.4mol•L-1
B.温度升高,该反应的平衡常数增大
C.选择合适的催化剂可降低该反应的活化能,提高M的转化率
D.实验1中M的化学反应速率为0.32mol•L-1•min-1
难度: 中等查看答案及解析
-
H3PO4是三元酸,如图是在常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。下列说法不正确的是( )
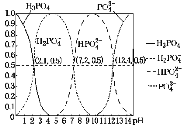
A.磷酸的第二级电离平衡常数约为10-7.2
B.在NaH2PO4溶液中:c(HPO42-)>c(H3PO4-)
C.在磷酸中滴加NaOH溶液至pH=7,c(Na+)=2c(HPO42)+c(H2PO4)
D.Na3PO4溶液中:c(Na+)=3c(PO43-)+3c(HPO42-)+3c(H2PO4-)+3c(H3PO4)
难度: 中等查看答案及解析
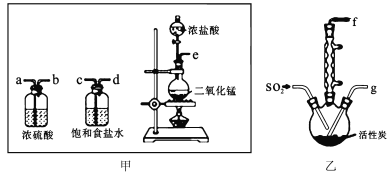
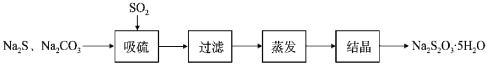

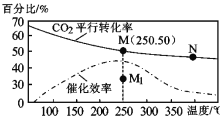
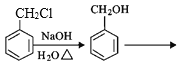
 ,其中第二步反应的方程式为_____。
,其中第二步反应的方程式为_____。