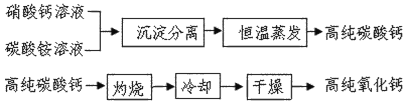
-
下列对某烷烃的命名正确的是( )
A.2,3-二甲基戊烷 B.3,4-二甲基戊烷
C.2,3-二甲基-4-乙基丙烷 D.2-甲基-3-乙基丁烷
难度: 中等查看答案及解析
-
下列实验操作中,先后顺序正确的是( )
A. 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
B. 检验某溶液中是否含SO42﹣,应先加入BaCl2溶液,再加入稀硝酸
C. 滴定管洗净后应先用蒸馏水润洗,然后再注入标准液进行滴定
D. 在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
难度: 中等查看答案及解析
-
化合物X(分子式为C2H6O)具有如下性质:X+Na→慢慢产生气泡;X+乙→有香味产物Y。以下判断正确的是
A.X的结构简式为CH3OCH3 B.香味产物分子式为 C4H10O3
C.X可由乙烯通过加成反应制得 D.X、Y和乙酸均能与烧碱反应
难度: 中等查看答案及解析
-
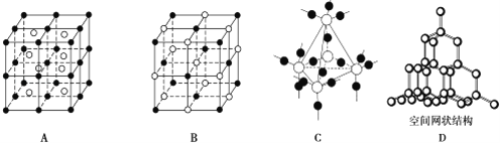
离子晶体一般不具有的特征是( )
A.熔点较高,硬度较大 B.易溶于水而难溶于有机溶剂
C.固体时不能导电 D.离子间距离较大,其密度较小
难度: 简单查看答案及解析
-
糖类根据能否水解及水解后产物,划分为单糖、低聚糖和多糖,下面叙述正确的是( )
A.糖类属于天然高分子化合物
B.1mol单糖水解后产生1mol水
C.1mol低聚糖水解后能产生2—10mol单糖
D.单糖不能水解,低聚糖水解后生成二糖,多糖水解后生成单糖
难度: 简单查看答案及解析
-
既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是( )
A. 通入足量的酸性高锰酸钾溶液 B. 与足量的溴水反应
C. 点燃 D. 在一定条件下与氢气加成
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 处于最低能量的原子叫做基态原子
B. 3p2表示3p能级有两个轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 中等查看答案及解析
-
关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性共价键 B.分子中不含非极性键
C.分子中只含σ键 D.分子中含有一个π键
难度: 简单查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
难度: 中等查看答案及解析
-
下列关于金属晶体的叙述不正确的是
A.常温下,金属单质不都以金属晶体形式存在
B.金属键在一定外力作用下,会因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越弱
难度: 中等查看答案及解析
-
下列说法中正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道图可表示为

D.3d3表示3d能级有3个轨道
难度: 简单查看答案及解析
-
下列离子半径的大小顺序正确的是
① Na+ ② X2-:1s22s22p63s23p6 ③ Y2-: 2s22p6 ④ Z-:3s23p6
A.③>④>②>① B.④>③>②>①
C.④>③>①>② D.②>④>③>①
难度: 中等查看答案及解析
-
某原子核外电子排布为ns2np7,它违背了
A. 能量最低原理 B. 泡利不相容原理 C. 洪特规则 D. 洪特规则特例
难度: 简单查看答案及解析
-
关于下列三种化合物的说法正确的是
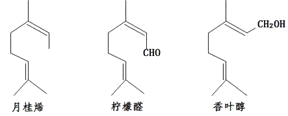
A.均不存在顺反异构体
B.不同化学环境的氢原子均为7 种
C.都可以发生加成反应、酯化反应、氧化反应
D.可以用金属钠和银氨溶液进行鉴别
难度: 中等查看答案及解析
-
鱼油的主要成分是EPA 和DHA,二者分别是二十碳五烯酸和二十二碳六烯酸,它们都是人体不可缺少的营养素,下列有关它们的说法不正确的是
①EPA和DHA含有相同的官能团,是同系物,化学性质相似
②1molEPA最多可与5molH2进行加成反应
③二者都既能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
④二者均是高分子化合物.
A.②④ B.①④ C.①③ D.②③
难度: 中等查看答案及解析
-
为防治“白色污染”,有一条重要途径是将合成高分子化合物重新变成小分子化合物。目前对结构式为
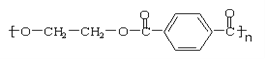 的化合物已成功实现了这种处理,其运用的原理是酯交换反应(即酯与醇在酸或碱的催化下生成一个新酯和一个新醇的反应)。试分析若用CH3OH来处理这种化合物能得到的有机物可能是
的化合物已成功实现了这种处理,其运用的原理是酯交换反应(即酯与醇在酸或碱的催化下生成一个新酯和一个新醇的反应)。试分析若用CH3OH来处理这种化合物能得到的有机物可能是A.
B.HO—CH2CH3
C.
D.
难度: 中等查看答案及解析
-
某学生为研究乙二酸(HOOC﹣COOH)的化学性质,进行如下实验:向盛有硫酸酸化的高锰酸钾溶液的试管中滴入适量乙二酸饱和溶液,振荡,观察到试管中溶液由紫红色变为无色。由此可知,乙二酸具有( )
A.氧化性 B.还原性 C.酸性 D.碱性
难度: 简单查看答案及解析
-
有下列几种反应类型:①消去 ②取代 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇 (
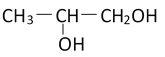 ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )A. ⑤⑥③① B. ⑤①④③ C. ⑤①④② D. ④①④②
难度: 中等查看答案及解析
-
化学已渗透到人类生活的各个方面,下列说法不正确的是( )
A. 国家有关部门提出超市、商场等场所限制使用塑料制品可以减少“白色污染”
B. 可以用Si3N4、Al2O3制作高温结构陶瓷制品
C. 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D. 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
难度: 简单查看答案及解析
-
下列说法正确的是
A.食用白糖的主要成分是蔗糖 B.小苏打的主要成分是碳酸钠
C.煤气的主要成分是丁烷 D.植物油的主要成分是高级脂肪酸
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.麦芽糖及其水解产物均能与新制氢氧化铜悬浊液反应
B.用溴水即可鉴别苯酚溶液、2,4﹣已二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.甘氨酸与盐酸反应的化学方程式为:HOOCCH2NH2+HCl→HOOCCH2NH3+Cl-
难度: 中等查看答案及解析
-
燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( )
A. 该有机物分子的结构简式为CH3—CH3
B. 该有机物中碳、氢元素原子数目之比为1∶3
C. 该有机物分子中不可能含有
双键
D. 该有机物分子中可能含有氧原子
难度: 中等查看答案及解析
-
下列关于碳原子的成键特点及成键方式的理解中正确的是( )
A.饱和碳原子不能发生化学反应
B.碳原子只能与碳原子形成不饱和键
C.具有六个碳原子的苯与环己烷的结构不同
D.五个碳原子最多只能形成四个碳碳单键
难度: 中等查看答案及解析
-
化合物丙可由如下反应得到

丙的结构简式不可能是( )
A. CH3CH(CH2Br)2 B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2Br D. CH3(CHBr)2CH3
难度: 中等查看答案及解析
-
某饱和一元醇与足量金属钠反应得到0.5gH2,取相同物质的量的该醇完全燃烧后得36g水.该醇应是
A.乙醇(C2H6O) B.丙醇(C3H8O)
C.丁醇(C4H10O) D.丙三醇(C3H8O3)
难度: 中等查看答案及解析