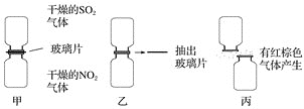
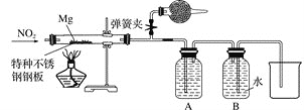
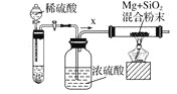
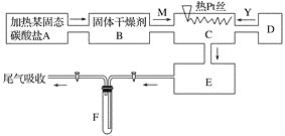
-
进行化学实验时必须注意安全,下列说法不正确的是
①不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛
②不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
③不慎将浓盐酸洒在桌面上,应立即用浓氢氧化钠溶液冲洗
④配制稀硫酸时,可先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
⑤酒精灯着火时可用水扑灭
A. ①②③ B. ③④⑤ C. ②③④ D. 全部
难度: 简单查看答案及解析
-
NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( )
A.NH4Cl中的N元素被还原
B.生成1 mol N2时转移的电子数为6 mol
C.NaNO2是氧化剂
D.N2既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.做CO还原CuO的实验时,尾气用点燃的方法除去
B.实验室制取O2、CO2,多余的少量气体可以排放到空气中
C.实验室产生的过量有毒尾气,一定要排放到室外空气中
D.“水滴石穿”是因为溶解了CO2的雨水与CaCO3作用生成Ca(HCO3)2
难度: 简单查看答案及解析
-
小明在实验室中配制稀NaOH溶液,将浓NaOH溶液倒入盛自来水的烧杯中时,发现溶液变浑浊,由此推测自来水中可能含有的离子是( )
A. Na+ B. Ba2+ C. Mg2+ D. Cl-
难度: 简单查看答案及解析
-
某学生配制0.1 mol·L-1氢氧化钠溶液 100 mL,下列操作会造成实际浓度偏高的是( )
A.空盘时天平指针指向左边
B.把烧碱放在滤纸上称量
C.定容时俯视刻度线
D.使用部分变质的烧碱
难度: 简单查看答案及解析
-
下列物品或设备的成分中含有二氧化硅的是( )
①门窗玻璃 ②水晶镜片 ③石英钟表 ④玛瑙首饰 ⑤硅太阳能电池 ⑥光导纤维 ⑦计算机芯片
A.①②③④⑥ B.全部 C.⑤⑦ D.①②⑥⑦
难度: 中等查看答案及解析
-
在前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是( )
A. 氢氧化铁胶体中滴加硫酸 B. 偏铝酸钠溶液中滴加盐酸
C. 氯化铝溶液中滴加烧碱溶液 D. 氯化铝溶液中滴加氨水
难度: 中等查看答案及解析
-
区别溶液和胶体最简单的方法是
A.丁达尔现象 B.闻气味
C.过滤 D.根据分散质微粒直径
难度: 简单查看答案及解析
-
将少量的二氧化碳通入下列溶液中,不能产生沉淀的是( )
A.硅酸钠溶液 B.石灰水 C.氢氧化钡溶液 D.氯化钙溶液
难度: 中等查看答案及解析
-
把氯气通入下列各物质的溶液中,阴离子和阳离子都能被氧化的是( )
A.NaOH B.Na2SO3 C.FeBr2 D.FeSO4
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO2↑
难度: 中等查看答案及解析
-
离子方程式CO32-+2H+=CO2↑+H2O表示( )
A.碳酸盐与盐酸之间的反应 B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与强酸之间的反应 D.可溶性碳酸盐与一切酸之间的反应
难度: 中等查看答案及解析
-
汞合金是目前使用较广泛的补牙材料,汞合金除含有汞外,还含有锌、锡铜等金属。下列有关汞合金说法不正确的是( )
A.汞合金是一种具有金属特性的物质 B.汞合金的强度和硬度比锡大
C.汞合金的熔点比汞低 D.汞合金的毒性远低于汞的毒性
难度: 中等查看答案及解析
-
关于酸、碱、盐的下列说法中错误的是( )
A. 酸在水溶液中电离产生的阳离子全部是氢离子
B. 碱在水溶液中电离产生的阴离子全部是氢氧根离子
C. 盐在水溶液中电离一定有金属阳离子产生
D. 酸和盐在水溶液中电离都可能有含氧酸根离子产生
难度: 中等查看答案及解析
-
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现.使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
难度: 中等查看答案及解析
-
某化学小组用图示装置制取氯气,下列说法不正确的是( )
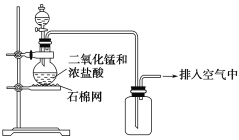
A.该装置图中至少存在两处明显错误
B.为了防止氯气污染空气,必须进行尾气处理
C.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
D.该实验中收集氯气的方法不正确
难度: 中等查看答案及解析
-
把各组中的气体通入溶液中,溶液的导电能力显著增强的是( )
A.CO2(g)通入NaOH溶液 B.CO2(g)通入石灰水
C.NH3(g)通入CH3COOH溶液 D.NH3(g)通入盐酸中
难度: 中等查看答案及解析
-
硫酸铵在强热条件下分解,生成NH3、SO2、N2和H2O,反应中生成的氧化产物和还原产物的物质的量之比是( )
A.1∶3 B.2∶3 C.1∶2 D.4∶3
难度: 简单查看答案及解析
-
某500mL溶液中含0.1mol Fe2+,0.2mol Fe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A. 0.4mol/L B. 0.6mol/L C. 0.8 mol/L D. 1.0 mol/L
难度: 简单查看答案及解析
-
在一定的条件下,只用一种试剂就能区别蒸馏水、硝酸银溶液和氢氧化钠溶液,这种试剂是( )
A.碳酸钠溶液 B.氯化铁溶液 C.硝酸钡溶液 D.硝酸钙溶液
难度: 简单查看答案及解析
-
我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要是:
①NH3+CO2+H2O =NH4HCO3
②NH4HCO3+NaCl =NaHCO3↓+NH4Cl
③2NaHCO3
Na2CO3+H2O+CO2↑
在上述反应中没有涉及到的基本反应类型是( )
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
难度: 简单查看答案及解析
-
下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)
5KCl+KClO3+3H2O
难度: 中等查看答案及解析
-
在标准状况下,气体摩尔体积约为22.4L·mol-1,则标准状况下0.5mol氢气的体积约为( )
A. 0.5 L B. 5 L C. 11.2 L D. 22.4 L
难度: 简单查看答案及解析
-
在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量、等溶质质量分数的稀硫酸,将天平调节至平衡。然后向左盘的烧杯中加入8.4g铁,反应物之间恰好完全反应。欲使天平恢复平衡,则可向右盘的烧杯中加入( )
A.8.4g碳酸钠 B.8.4g氧化钙 C.8.4g镁 D.8.4g碳酸镁
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
B.碳酸钙与盐酸反应CO32-+2H+=CO2↑十H2O
C.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
难度: 简单查看答案及解析
-
一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl﹣
B.含有大量OH-的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3﹣、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl﹣
难度: 中等查看答案及解析