-
下列说法正确的是( )
A. 宏观物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子或分子
B. 利用化学反应,我们可以制造出新的分子,但不能制造出新原子
C. 分子构成的物质,分子间作用力越大,分子越稳定
D. 阴、阳离子间通过静电引力而形成的化学键叫作离子键
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦ B.只有①⑦ C.只有⑦ D.只有①⑤⑦
难度: 困难查看答案及解析
-
下列有关能量转换的说法正确的是( )
A.煤燃烧是热能转化为化学能的过程
B.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
C.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
D.化石燃料属于一次能源,电能属于二次能源
难度: 中等查看答案及解析
-
某短周期金属元素原子核外最外层电子数是最内层电子数的1.5倍,下列说法正确的是( )
A. 该元素的单质性质活泼,具有较强的还原性,可以用于某些金属冶炼
B. 该元素的单质常温下不与浓硫酸反应
C. 该元素的单质无需特别保存,因为其性质稳定,不易与空气中的成分反应
D. 该元素的最高价氧化物对应的水化物只能与酸反应
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是( )
A. ⅠA族元素是同周期中金属性最强的元素
B. 非金属元素组成的化合物中只含共价键
C. 同种元素的原子均有相同的质子数和中子数
D. S、Cl的含氧酸的酸性依次增强
难度: 简单查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,两元素核电荷数之和与W、Z的原子序数之和相等,则下列说法正确的是( )
A. Z元素的含氧酸是最强酸
B. 原子半径:X>Z
C. 气态氢化物热稳定性:W>X
D. W与Y可以存在于同一离子化合物中
难度: 中等查看答案及解析
-
下列对化学用语的理解,正确的是( )
A. 结构式: A=B=A,既可以表示CO2,也可以表示SiO2
B. 电子式
可以表示羟基,也可以表示氢氧根离子
C. 比例模型
 :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子D. 离子结构示意图
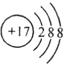 :可以表示35Cl-,也可以表示37Cl-
:可以表示35Cl-,也可以表示37Cl-难度: 简单查看答案及解析
-
如图为元素周期表短周期的一部分,e原子的电子层为n,最外层电子数为2n+1。下列叙述不正确的是( )
a
b
c
d
e
A. a、d、e的最高价氧化物对应的水化物的酸性依次增强
B. a 与b形成的阴离子可能有ab32-、a2b42-
C. ad2分子中每个原子的最外层均为8电子结构
D. c 和e 氢化物的热稳定性和还原性均依次减弱
难度: 简单查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
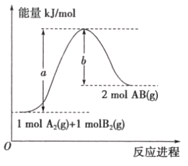
A. 每生成2 分子AB(g)吸收bkJ 热量
B. 该反应热△H=+(a-b) kJ /mol
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA-A和1molB-B键,放出akJ能量
难度: 简单查看答案及解析
-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
难度: 中等查看答案及解析
-
已知2SO2+O2
2SO3为放热反应,对该反应的下列说法正确的是( )
A. O2或SO2的能量一定高于SO3的能量
B. SO2和O2的总能量一定高于SO3的总能量
C. 硫在纯氧中燃烧时,若O2过量则一定生成SO3
D. 因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的电极反应式为2Li++FeS+2e-=Li2S+Fe。下列有关该电池的说法中正确的是( )
A. Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B. 该电池的总反应式为2Li+FeS=Li2S+Fe
C. 负极的电极反应式为Al-3e-=Al3+
D. FeS在正极发生氧化反应
难度: 简单查看答案及解析
-
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3 ②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸 ④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体
A. 全部 B. 只有①②
C. 只有①②③④ D. 只有①②④⑤
难度: 中等查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的四种短周期元素,X 的一种同素异形体具有杀菌、消毒能力,Y单质与X单质在不同条件下反应会生成2种不同化合物,Z简单离子的半径是同周期元素简单离子中最小的,H2在W 单质中燃烧产生苍白色火焰。下列说法正确的是( )
A. 简单离子半径: W>Y>X
B. Z 与W 形成的化合物在熔融状态下能导电
C. 电解Y、W 形成的化合物,无论是熔融状态下还是水溶液中,都能得到单质W
D. 单质X1mol与单质Y充分反应一定转移4mol电子
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M 层电子数的3倍,下列说法不正确的是( )
X
Y
Z
W
Q
A. X 与Y 可形成的化合物在5种以上
B. 工业上常常通过电解Z 的熔融氧化物的方法来获得Z 的单质
C. 这五种元素形成的简单离子的半径由大到小的顺序为W>Q>X>Y>Z
D. W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构
难度: 中等查看答案及解析
-
2016年IUPAC命名117号元素为Ts (中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. HTs 易溶于水,稳定性强,还原性强
难度: 简单查看答案及解析
-
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定②HCl 和H2S的水溶液,前者的酸性强 ③HClO4的酸性比H2SO4的强④Cl2 能与H2S 反应生成S ⑤Cl原子能得1个电子变成稳定离子,而S 原子能得2 个电子⑥Cl2 与Fe 反应生成FeCl3,S 与Fe 反应生成FeS
A. ①②④ B. ①②⑥
C. ②⑤ D. ①③⑤
难度: 中等查看答案及解析
-
分析如图所示的四个原电池装置。其中结论正确的是( )


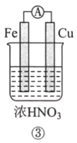

A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,OH-向Al 电极移动
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为2Na++2e-=2Na
难度: 中等查看答案及解析
-
已知A、B、C、D 为短周期元素构成的四种物质,它们有如下转化关系且D 为强电解质(其他相关物质可能省略)。下列说法不正确的是( )
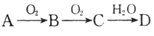
A. 若A 为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2∶3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第2周期ⅣA族
C. 不论A 为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化
D. 若A 是共价化合物,0.1molA 分子中含有的电子数可能为NA (NA 为阿伏加德罗常数的值)
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是( )
A. X、Y、Z、W的原子半径的大小关系为W>Y>Z>X
B. 在Y2X2、ZX4、X2W2的一个分子中,所含的共用电子对数相等
C. X、Y、Z、W四种元素可形成化学式为X5Y2ZW2的化合物
D. 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
难度: 中等查看答案及解析