-
下列离子方程式书写正确的是
A. 氢氧化镁与盐酸反应:OH-+H+=H2O
B. 氯化铁溶液与铜反应:Fe3++Cu =Fe2++Cu2+
C. 过量二氧化碳通入水玻璃中:2CO2+SiO32-+ 2H2O =2HCO3-+H2SiO3↓
D. 硫酸氢铵溶液和过量的氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
在pH相同,体积相等的盐酸A和醋酸溶液B中,分别加入等质量的锌,若反应停止后,有一份溶液中锌有剩余,则正确的判断是
①生成等量H2时反应所需时间B>A ②开始时反应速度A>B
③参加反应的锌的质量B>A ④整个反应阶段平均速度B>A
⑤盐酸中锌有剩余 ⑥醋酸溶液中锌有剩余
⑦盐酸中放氢气多 ⑧醋酸溶液中放氢气多
A. ③④⑤⑧ B. ①③⑥⑦ C. ①②③⑥ D. ②③④⑤
难度: 困难查看答案及解析
-
在一定条件下,可发生反应:RO3n-+F2 +2OH-=RO4-+2F-+H2O。则RO3n-中R元素的化合价是( )
A.+4 B.+5 C.+6 D.+7
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒
C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查
难度: 简单查看答案及解析
-
同温同压,相同体积的CO和C2H4具有相同的:
①分子数 ②原子总数 ③碳原子数 ④质量
A.①②③④ B.②③④ C.①②③ D.①④
难度: 中等查看答案及解析
-
下列溶液中氢离子浓度最小的是
A.10L0.10mol/LCH3COOH溶液 B.2L 0.05mol/L H2SO4溶液
C.lL0.10mol/LHNO3溶液 D.2L0.1mol/LHCl溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,11.2 L H2O2中含有共用电子对数目为1.5 NA
B.56 g Fe与过量稀硝酸反应,转移电子数目为2 NA
C.密闭容器中1 mol PCl3与1 mol Cl2充分反应,生成 PCl5分子数目为NA
D.将1 mol CH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目为NA
难度: 中等查看答案及解析
-
“分类”是一种思想方法,在化学发展中起到了重要的作用。下列说法正确的是( )
A.Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
B.根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
C.只有溶于水能够导电的化合物才是电解质
D.冰和干冰既是纯净物又是化合物
难度: 中等查看答案及解析
-
下列关于溶液物质的量浓度的说法正确的是( )
A.常温下,1L水中溶解58.5gNaCl,该溶液的物质的量浓度为1mol•L﹣1
B.标准状况下,将22.4L HCl溶于1L水,可配成1mol•L﹣1的稀盐酸
C.将4.0g NaOH倒入100mL容量瓶中,加水至刻度线,即可配成1mol•L﹣1的NaOH溶液
D.10g 98%的硫酸(密度为1.84g•cm﹣3)与10mL 18.4mol•L﹣1的硫酸的浓度相同
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A.H+、Fe2+、Cl-、NO3- B.Mg2+、K+、OH-、Cl-
C.NH4+、Ca2+、NO3-、CO32- D.K+、H+、Cl-、SO42-
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
C.向水中加入金属钠,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH不变
难度: 中等查看答案及解析
-
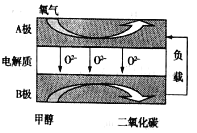
通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是( )
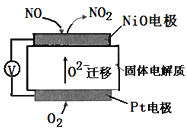
A.O2-由负极向正极移动
B.负极的电极反应式为:NO-2e-+O2-=NO2
C.O2在电极上的还原产物是H2O
D.反应消耗的NO与O2的物质的量之比为1:2
难度: 简单查看答案及解析
-
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.电子由Zn电极流出,经KOH溶液流向正极
B.正极反应式为2Fe
+
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向负极迁移
难度: 困难查看答案及解析
-
已知,一些铅盐的溶度积如下:
化合物
PbSO4
PbCO3
PbS
PbCl2
溶度积Ksp
1.82×10-8
1.46×10-13
9.04×10-29
1.17×10-5
由上述数据可知,要除去工业废水中的Pb2+,沉淀剂最好选用( )
A.硫酸盐 B.硫化物 C.碳酸盐 D.盐酸盐
难度: 简单查看答案及解析
-
下列说法正确的是
A.活化分子间所发生的碰撞为有效碰撞
B.由C(s,石墨)=C(s,金刚石) △H>0可知,金刚石比石墨稳定
C.NH4HCO3(s) =NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
难度: 中等查看答案及解析
-
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A.Cu能与浓硝酸反应,但不能与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Fe与浓盐酸反应比与稀盐酸反应快
难度: 简单查看答案及解析
-
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)⇌2C(g);ΔH>0(表示吸热)。平衡移动关系如图所示,下列说法正确的是( )
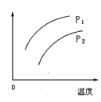
A.P1>P2,纵坐标指C的质量分数 B.P1<P2,纵坐标指A的质量分数
C.P1<P2,纵坐标指A的转化率 D.P1<P2,纵坐标指混合气体的平均摩尔质量
难度: 简单查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
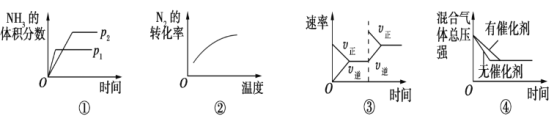
A.①压强对反应的影响(p2>p1) B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响 D.④催化剂对反应的影响
难度: 中等查看答案及解析
-
下列说法中,能说明化学平衡一定向正反应方向移动的是( )
A.N2O4(g)
2NO2(g),改变某一条件后,气体颜色加深
B.H2(g)+I2(g)
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C.N2(g)+3H2(g)
2NH3(g),改变某一条件后,NH3的体积分数增加
D.2SO2(g) +O2(g)
2SO3(g),恒温恒压条件下,充入He
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下进行如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=﹣746.4kJ•mol﹣1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入氮气 D.降低温度同时增大压强
难度: 简单查看答案及解析
-
下列事实不能证明H2C2O4(乙二酸)是弱电解质的是( )
A.草酸能使酸性KMnO4溶液褪色
B.常温下,0.1mol/L的H2C2O4溶液的pH=2
C.浓度均为1mol/L=l的H2C2O4溶液的导电能力比硫酸的导电能力弱
D.常温下,pH=4的H2C2O4溶液稀释100倍,pH约为5
难度: 中等查看答案及解析
-
室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
难度: 中等查看答案及解析
-
下列应用与盐类的水解无关的是
A.明矾用于净水
B.次氯酸钠常用作消毒剂
C.FeCl3溶液滴入沸水中制Fe(OH)3胶体
D.用碳酸氢钠和硫酸铝两种溶液可制成泡沫灭火剂
难度: 中等查看答案及解析
-
下列说法正确的是
A.0.1mol/LpH 为9 的NaHB 溶液中:c(HB-) >c(B2-)>c(H2B)
B.将标准状况下的2.24 LCO2通入150 mL1mol/L NaOH 溶液中,所得溶液中c(CO32-)>c(HCO3-)
C.室温下,c(NH4+)相同的①(NH4)2CO3②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液浓度大小顺序为:①>②>③
D.常温时①pH=12 的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>①
难度: 中等查看答案及解析
-
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。对于浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
难度: 中等查看答案及解析