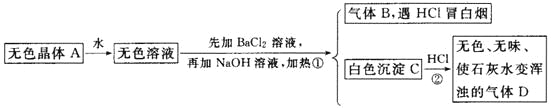
-
下列有关物质分类或归类正确的一组是( )
A. 漂白粉是化合物 B. 水玻璃是纯净物
C. 盐酸是电解质 D. 纯碱不属于碱
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,硫酸钡是非电解质;
②氨溶于水得到氨水溶液能导电,氨水是电解质;
③固态氯化氢不导电,液态氯化氢可以导电;
④硫酸氢钠电离出的阳离子有氢离子,硫酸氢钠是酸;
⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A. 仅①④ B. 仅①④⑤
C. 仅②③ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列状态的物质,既属于电解质又能导电的是( )
A. 氯化镁晶体 B. 氯化钠溶液
C. 液态氯化氢 D. 熔融氢氧化钾
难度: 简单查看答案及解析
-
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2.由此判断下列说法正确的是
A. 铁元素在反应①中被还原,在③中被氧化
B. 反应②中当有1mol Cl2被氧化时,有2mol Br-被还原
C. 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+
D. 还原性强弱顺序为:I->Fe2+>Br->Cl-
难度: 中等查看答案及解析
-
下列碳原子的物质的量为1 mol的是( )
A. 0.012 kg C B. 0.012 kg12C
C. 0.012 kg13C D. 0.012 kg12C和13C
难度: 简单查看答案及解析
-
下列实验操作中正确的是
A.用25mL量筒量取4.0mol·L-1的盐酸5.62mL
B.做蒸馏操作时,冷凝水方向是下进上出
C.用溶解、过滤、蒸发的方法分离氯化钠与硝酸钾的混合物
D.用蒸发皿灼烧胆矾(CuSO4•5H2O)得到CuSO4
难度: 中等查看答案及解析
-
下列反应的离子方程式中,正确的是
A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
B.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
C.碳酸钙溶于醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O
D.澄清石灰水与稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O
难度: 简单查看答案及解析
-
能证明某溶液中含有氯化钠的是( )
A. 焰色反应是黄色
B. 溶液有咸味
C. 取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D. 焰色反应是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
难度: 简单查看答案及解析
-
镁条在空气中燃烧后,其生成物中可能含有的物质是
A.MgCO3、MgO、Mg3N2 B.Mg(OH)2、MgO、MgCO3
C.MgO、Mg3N2、C D.Mg3N2、C、MgCO3
难度: 简单查看答案及解析
-
某同学血液化验单中“葡萄糖”的结果为5.04×10-3mol·L-1。这里的“5.04×10-3mol·L-1”表示葡萄糖的 ( )
A.物质的量 B.摩尔质量 C.质量分数 D.物质的量浓度
难度: 简单查看答案及解析
-
在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是
A.FeCl3溶液有杀菌消毒作用
B.FeCl3溶液能使血液聚集沉降
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3能使血液发生化学反应
难度: 简单查看答案及解析
-
国家质检部门检出人们端午节包粽子的“返青粽叶”多以胆矾(化学式为CuSO4·5H2O)为添加剂,长期食用有害健康,请问胆矾是一种( )
A. 氧化物 B. 盐 C. 碱 D. 酸
难度: 中等查看答案及解析
-
、下列离子方程式书写正确的是( )
A.向氢氧化钠溶液中通入足量二氧化碳:OH﹣+CO2===HCO3-
B.氧化钠投入水中发生反应:O2﹣+H2O===2OH﹣
C.硝酸银溶液中加入铜粉:Ag++Cu===Cu2++Ag
D.金属铁溶于稀硫酸中:2Fe+6H+===2Fe3++3H2↑
难度: 中等查看答案及解析
-
硅及其化合物的应用范围很广。下列说法正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.石英玻璃和餐桌上的瓷盘都是硅酸盐制品
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
难度: 简单查看答案及解析
-
如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )

A.①单质、③化合物
B.②碱、⑤氧化物
C.④碱、⑤含氧化合物
D.④含氧化合物、③氧化物
难度: 简单查看答案及解析
-
把下列四种物质分别加入到盛有100 mL蒸馏水的烧杯中,不能使蒸馏水导电性发生明显变化的是( )
A.10 g NaCl固体
B.10 g NaOH固体
C.10 g BaSO4固体
D.10 g Cu(NO3)2固体
难度: 简单查看答案及解析
-
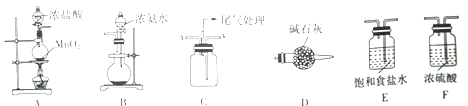
收集纯净的氯气,最好选用( )
A. 向上排空气法 B. 向下排空气法
C. 排水法 D. 排饱和食盐水法
难度: 简单查看答案及解析
-
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O═2NaOH+H2↑ B.CaCO3+2HCl═CaCl2+H2O+CO2↑
C.2KClO3
2KCl+3O2↑ D.CH4+2O2
CO2+2H2O
难度: 简单查看答案及解析
-
同温同压下,相同物质的量的铝、铁分别与足量盐酸反应时,放出氢气的体积比是( )
A.1∶1 B.3∶1 C.3∶2 D.2∶3
难度: 中等查看答案及解析
-
常温下,二氧化硅是很坚硬的固体,而二氧化碳是气体,这一差别的根本原因是( )
A.二氧化硅不溶于水,二氧化碳能溶于水
B.硅元素与碳元素的非金属活泼性不同
C.二氧化硅分子与二氧化碳分子的结构不同
D.二氧化硅是具有立体网状结构的晶体,二氧化碳则是由分子组成
难度: 简单查看答案及解析
-
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中氢离子浓度为0.1 mol·L-1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol 硫酸 B.气体甲中二氧化硫与氢气的体积比为4∶1
C.反应中共消耗97.5 g 锌 D.反应中共转移3 mol电子
难度: 中等查看答案及解析
-
下列关于硫的叙述中不正确的是( )
A.在自然界中既有化合态的硫又有能以游离态的形式存在的硫
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.实验室常用酒精除去附着在试管壁上的硫黄
D.硫是黑火药的主要成分之一
难度: 中等查看答案及解析
-
某同学欲配制含有大量下列各离子的溶液,其中能实现的是( )
A.K+ H+
OH- B.Na+ Ca2+
C.Na+ H+ Cl-
D.Na+ Cu2+ Cl-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
难度: 简单查看答案及解析
-
下列关于氧化钠和过氧化钠的叙述中,正确的是( )
A.都属于碱性氧化物 B.都能与水发生化合反应
C.水溶液的成分相同 D.与二氧化碳反应生成不同的盐
难度: 简单查看答案及解析
-
下列事实与胶体的性质有关的是( )
①用盐卤点豆腐 ②用明矾净水 ③医药上用三氯化铁止血 ④江河入海口形成三角洲
A.只有①② B.只有①②④ C.只有①②③ D.全部
难度: 简单查看答案及解析