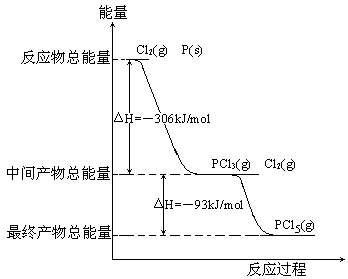
-
下列叙述正确的是
A.电能是二次能源 B. 水力是二次能源
C.天然气是二次能源 D. 水煤气是一次能源
难度: 简单查看答案及解析
-
下列叙述正确的是
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通人SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
难度: 困难查看答案及解析
-
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)
N2(g)+2CO2(g)。下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/mol·L—1
V/mL
c/mol·L—1
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
已知热化学方程式:SO2(g)+ O2(g)
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
A. 196.64kJ B. 196.64kJ/mol
C. <196.64kJ D. >196.64kJ
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反映的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 困难查看答案及解析
-
对平衡CO2(g)
CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压
C.升温减压 D.降温增压
难度: 中等查看答案及解析
-
反应:A(气)+3B(气) 2C(气) ∆H<0 达平衡后,将气体混和物的温度降低,下列叙
述中正确的是( )
A、正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B、正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 .
C、正反应速率和逆反应速率都变小,平衡向正反应方向移动
D、正反应速率和逆反应速率都变小,平衡向逆反应方向移动
难度: 困难查看答案及解析
-
在新制的氯水中存在平衡:Cl2+H2O HCl+HClO。加入少量下列物质能使c(HClO)增大
( )
A.CaSO4 B.NaOH C.CaCO3 D.HCl
难度: 中等查看答案及解析
-
已知:H2(g)+I2(g)
2HI(g);△H < 0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
难度: 困难查看答案及解析
-
高温下,某反应达平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O=CO2+H2
难度: 中等查看答案及解析
-
某温度下,在容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加2mol D.均减少2mol
难度: 困难查看答案及解析
-
恒温恒压下,在容积可变的器皿中,反应2NO2(g)
N2O4(g) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.不变 B.增大 C.减小 D.无法判断
难度: 中等查看答案及解析
-
已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
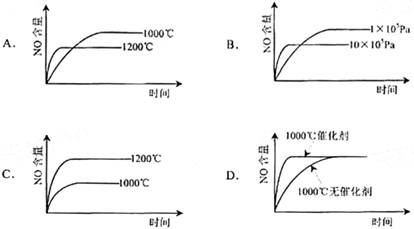
难度: 中等查看答案及解析
-
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
难度: 中等查看答案及解析
-
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2 (s)+2I2 (g)
TaS2 (s)+2I2 (g) TaI4 (g)+S2 (g)
下列说法正确的是
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
C.在提纯过程中,I2 的量不断减少
D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B . 16 C.20 D.25
难度: 困难查看答案及解析
-
在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g)
x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
难度: 困难查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
难度: 中等查看答案及解析

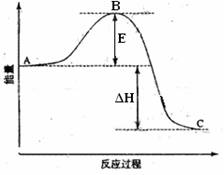 (8分)2SO2(g)+O2(g)
(8分)2SO2(g)+O2(g)