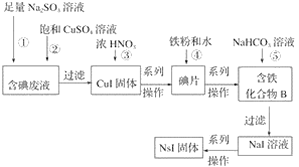
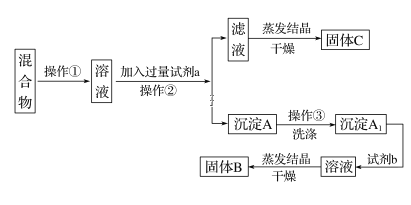
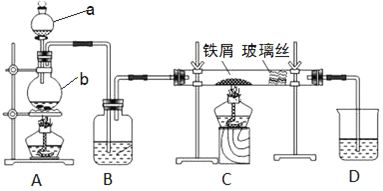
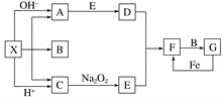
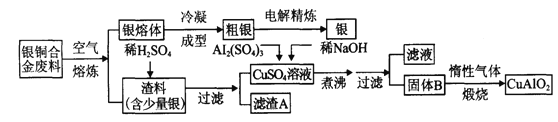
-
在下列物质的分类中,前者包括后者的是
A. 氧化物、酸性氧化物 B. 含氧酸、酸
C. 碱性氧化物、碱 D. 酸式盐、盐
难度: 简单查看答案及解析
-
有关胶体等分散系的制备、性质的相关说法不正确的是
A. 向沸水中逐滴加入氯化铁饱和溶液,继续煮沸至液体呈红褐色,即制得氢氧化铁胶体
B. 向氢氧化铁胶体中加入稀硫酸至过量,现象为先生成红褐色沉淀,之后沉淀溶解
C. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
D. 将氢氧化铁胶体与硅酸溶胶相互混合,混合液变浑浊
难度: 简单查看答案及解析
-
下列叙述正确的是
A.直径介于1~100 nm之间的粒子称为胶体
B.用过滤的方法可以将胶体和溶液分离
C.利用丁达尔效应可以区别溶液与胶体
D.胶体区别于其他分散系的本质特征是丁达尔效应
难度: 简单查看答案及解析
-
下列物质中,能够导电的电解质是( )
A. 铜丝 B. 熔融的MgCl2 C. NaCl溶液 D. 蔗糖
难度: 简单查看答案及解析
-
下列关于二氧化硅和二氧化碳的说法中不正确的是( )
A. 都是酸性氧化物 B. 都能与水反应
C. 都与氢氧化钠溶液反应 D. 高温下都与单质碳反应
难度: 中等查看答案及解析
-
将40 mL二氧化氮和一氧化氮的混合气体通入倒立于水槽中盛满水的试管中,充分反应后试管中剩下20 mL气体,则原混合气体中二氧化氮和一氧化氮的体积比为( )
A. 2∶1 B. 1∶3
C. 3∶1 D. 1∶1
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 1molCH5+中含有的电子数为11NA
B. 常温常压下,2.24LCO和CO2的混合气体中含有的碳原子数为0.1NA
C. 室温下,0.1mol·L-1的NaOH溶液中所含OH-的个数为0.1NA
D. 常温常压下,18gH2O中含有的原子总数为3NA
难度: 简单查看答案及解析
-
下列关于水泥和普通玻璃工业生产的叙述正确的是
①产品都是硅酸盐 ②反应条件都是高温 ③都用含有硅的物质作原料 ④反应原理都是一系列复杂的物理化学变化
A.①③ B.①②③ C.①③④ D.①②③④
难度: 简单查看答案及解析
-
容量瓶上需标有:①温度 ②浓度 ③容量 ④压强⑤刻度线 五项中的:( )
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 简单查看答案及解析
-
已知反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
难度: 中等查看答案及解析
-
多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含CuCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是( )
A.Cu
B.H2
C.Mg
D.不能确定
难度: 中等查看答案及解析
-
某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
难度: 中等查看答案及解析
-
在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A. 新制氯水使红玫瑰变为白玫瑰,说明有Cl2
B. 加入石蕊溶液,溶液变红,说明该溶液一定不含HClO
C. 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D. 光照新制氯水有气泡逸出,该气体一定是O2
难度: 中等查看答案及解析
-
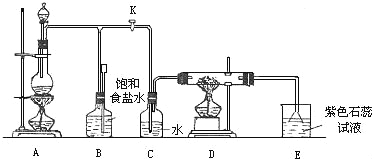
喷泉是一种常见的自然现象,如下图是化学教材中常用的喷泉实验装置,在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是
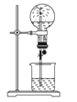
A. HCl和H2O B. CO2和NaOH溶液 C. NH3和H2O D. O2和H2O
难度: 中等查看答案及解析
-
在无色透明的酸性溶液中,下列离子能大量共存的是( )
A.K+ Cu2+
B.
Na+ Cl-
C.Al3+ Cl-
Mg2+ D.H+ Ba2+
难度: 简单查看答案及解析
-
某溶液中含有Na+、
、
、
4种离子,若向其中加入少量过氧化钠固体后,溶液中离子浓度基本保持不变的是( )
A.
B.Na+
C.
D.
难度: 简单查看答案及解析
-
实验室加热高锰酸钾制取氧气,用排水法收集满氧气后,下一步应采取的操作及原因是
A. 先熄灭酒精灯,以节约燃烧
B. 先把导管移出水面,再熄灭酒精灯以免水倒吸引起试管炸裂
C. 先撤酒精灯,再撤导气管,防止水倒吸
D. 检验收集的气体是否纯净
难度: 中等查看答案及解析
-
有下列三个反应:①Cl2+FeI2= FeCl2+I2②2Fe2++Br2= 2Fe3++2Br—
③Co2O3+6HCl = 2CoCl2+ Cl2↑+3H2O,下列说法正确的是( )
A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2>Co2O3>Fe3+
C.在反应③中生成1molCl2时,有2molHCl被氧化
D.根据反应①②一定可以推理得到Cl2+FeBr2= FeCl2+Br2
难度: 中等查看答案及解析
-
将盛有氮气和二氧化氮(无N2O4)混合气体的试管倒立于水中,经过足够长时间后,试管内气体的体积缩小为原来的一半,则原混合气体中氮气与二氧化氮的体积比是( )
A. 1∶1 B. 1∶2 C. 1∶3 D. 3∶1
难度: 中等查看答案及解析
-
下列物质制取的化学方程式中,不属于氧化还原反应的是( )
A.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑
C.实验室制取氯气:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
D.工业上制取二氧化氯:2NaClO3+4HCl(浓)=2NaCl+2H2O+2ClO2↑+Cl2↑
难度: 简单查看答案及解析
-
工业上利用二氧化硅来制取高纯度的硅(硅含量达99.9%以上),反应过程中不需要用到的反应物是 ( )
A.C B.H2 C.CO D.Cl2
难度: 简单查看答案及解析
-
为刻蚀在玻璃上的精美的花纹图案,则刻蚀过程中发生的主要化学反应为( )
A. CaCO3+2HCl=CaCl2+H2O+CO2↑
B. NaHCO3+HCl=NaCl+H2O+CO2↑
C. Si+4HF=SiF4↑+2H2↑
D. SiO2+4HF=SiF4↑+2H2O
难度: 简单查看答案及解析
-
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
难度: 中等查看答案及解析
-
某学生用托盘天平称量食盐时,他将食盐放在右盘,砝码放在左盘,称得食盐的质量为15.5 g(1g以下使用游码)。该学生所称量的食盐的实际质量是( )
A.15.5 g B.15.0 g C.16.0 g D.14.5g
难度: 简单查看答案及解析
-
用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是
A.将FeCl3溶液滴入蒸馏水中即可
B.将FeCl3溶液滴入热水中,得到棕黄色液体即可
C.将FeCl3溶液滴入沸水中,并继续煮沸,得到红褐色液体即可
D.将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可
难度: 简单查看答案及解析