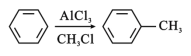
-
地球在流浪,学习不能忘”,学好化学让生活更美好。下列说法错误的是
A.港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物
B.“玉兔二号”月球车首次在月球背面着陆,其帆板太阳能电池的材料是SiO2
C.《天工开物》中“凡石灰经火焚炼为用”,其中“石灰”指的是CaCO3
D.宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.78g Na2O2固体含有离子的数目为4NA
B.由水电离出的c(H+)=10−12mol·L−1溶液中Na+、NH4+、SO42−、NO3− 一定能大量共存
C.硫酸酸化的KI淀粉溶液久置后变蓝的反应为:4I−+O2+4H+=2I2+2H2O
D.将充有NO2的玻璃球浸到热水中气体颜色加深说明2NO2(g)
N2O4(g) △H >0
难度: 简单查看答案及解析
-
螺环烃是指分子中两个碳环共用一个碳原子的脂环烃。
是其中的一种。下列关于该化合物的说法正确的是
A.分子式为C10H12
B.一氯代物有五种
C.所有碳原子均处于同一平面
D.能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
二氧化氯(ClO2)是易溶于水且不与水反应的黄绿色气体,沸点为11℃。某小组在实验室中制备ClO2的装置如下:[已知:SO2+2NaClO3+H2SO4=2ClO2 +2NaHSO4]
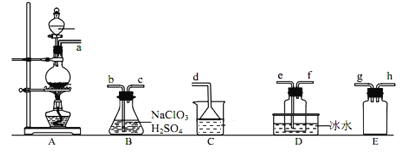
下列说法正确的是
A.装置C中装的是饱和食盐水,a逸出的气体为SO2
B.连接装置时,导管口a应接h或g,导管口c应接e
C.装置D放冰水的目的是液化SO2,防止污染环境
D.可选用装置A利用1mol·L−1盐酸与MnO2反应制备Cl2
难度: 中等查看答案及解析
-
某同学设计了如图所示元素周期表,已知Z元素的最外层电子数是次外层的3倍。空格中均有对应的元素填充。下列说法正确的是
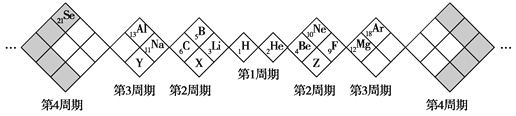
A.白格中都是主族元素,灰格中都是副族元素
B.X、Y分别与Z形成的化合物都只有两种
C.X、Y元素最高价氧化物对应的水化物酸性:X>Y
D.X、Y、Z的气态氢化物中最稳定的是X的氢化物
难度: 中等查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料,某固体氧化物为电解质的新型燃料电池。该电池的工作温度可高达700~900℃,生成物均为无毒无害的物质。下列说法错误的是
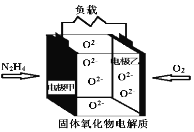
A.电池总反应为:N2H4+2O2=2NO+2H2O
B.电池内的O2−由电极乙移向电极甲
C.当甲电极上消耗lmol N2H4时,乙电极理论上有 22.4L(标准状况下)O2参与反应
D.电池正极反应式为:O2+4e−=2O2−
难度: 中等查看答案及解析
-
25℃时,取浓度均为0.1 mol·L−1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L−1 氢氧化钠溶液和0.1 mol·L−1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
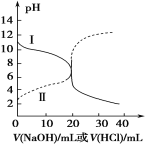
A.曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7
C.曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
难度: 中等查看答案及解析