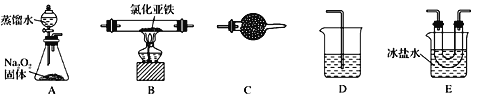
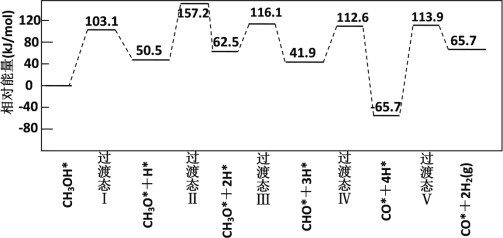
-
港珠澳大桥使用了大量的各类材料:路面使用了进口的湖底天然沥青和混凝土,承台和塔座等部位使用了双相不锈钢钢筋,抗震方面使用了新型高阻尼橡胶和钢板。关于这些材料的说法错误的是
A.沥青主要成分是有机物,也可以通过石油分馏得到
B.混凝土中的水泥和沙子的主要成分都是硅酸盐
C.不锈钢是通过改变材料的结构的途径防锈蚀
D.新型高阻尼橡胶是复合材料
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.28g乙烯与丙烯混合物中含C-H键的数目为4NA
B.标准状况下,22.4L氦气与11.2LH2含有的质子数均为NA
C.1mol Cl2与足量的铁在一定条件下充分反应,转移了3NA电子
D.25℃时,1LpH=11的NaOH溶液与1LpH=11的CH3COONa溶液,含阴离子数均为10-11NA
难度: 简单查看答案及解析
-
两个环共用两个不直接相连的碳原子的化合物称为桥环化合物,某桥环化合物的结构简式如图所示,下列关于该化合物的说法错误的是
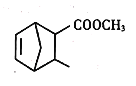
A.该有机物的分子式为C10H14O2
B.该有机物分子与HBr发生加成反应的产物只有一种
C.该有机物分子中含有两个官能团
D.该有机物能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,甲、乙分别是X、W两元素对应的单质,丙、丁是由这些元素组成的二元化合物,戊是Z的最高价氧化物对应的水化物,且25℃时0.1mol/L 戊溶液的pH为13,工业上通过电解丙和丁的混合物来制取甲、乙、戊。下列说法不正确的是
A.原子半径:Z>W>Y>X
B.元素Y与X、Z都能组成两种化合物
C.乙与戊的水溶液反应后所得溶液可作消毒液
D.Z分别与X、Y、W形成的化合物中一定没有共价键
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
向KI溶液中加入CCl4,振荡后静置
液体分层,下层呈紫红色
碘易溶于CCl4,难溶于水
B
NaHCO3溶液与NaAlO2溶液混合
生成白色沉淀
结合H+的能力:
CO32->AlO2-
C
将SO2通入Ba(NO3)2溶液中
生成白色沉淀
生成了BaSO4
D
向2支盛有2mL相同浓度的NaOH溶液的试管中分别滴入2滴相同浓度的AlCl3和MgCl2溶液,振荡并静置
前者无沉淀,后者有白色沉淀
Ksp[Al(OH)3]>
Ksp[Mg(OH)2]
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
Al-Ag2O电池用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是
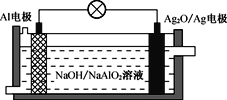
A.电子由Al电极通过外电路流向Ag2O/Ag电极
B.电池负极附近溶液pH下降
C.溶液中OH-向Al电极移动
D.Al极反应式为:Al-3e-+3OH-=Al(OH)3
难度: 中等查看答案及解析
-
25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG[AG=lg
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是
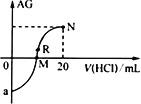
A.若a=-8,则25℃时,0.1mol·L-1XOH溶液的pH=8
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度逐渐减小
难度: 困难查看答案及解析