-
若将NaOH(s)、P2O5(s)、无水CaCl2(s)归为一类.从A~D中选出一种最适宜与这三种物质归为一类的是( )
A.浓硫酸
B.氯化钠
C.碱石灰
D.生石灰难度: 中等查看答案及解析
-
下列有关物质结构的表述正确的是( )
A.次氯酸的电子式
B.乙烯的分子式CH2=CH2
C.碳-12原子126C
D.钠离子的结构示意图难度: 中等查看答案及解析
-
下列物质中微粒的个数比不是1:1的是( )
A.NaHCO3晶体中的阴离子和阳离子
B.Na2O2固体中的阴离子和阳离子
C.重氢(12H)原子中的质子和中子
D.NH3分子中的质子和电子难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.将1mol/LNaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO-4、SO2-4
②pH=11的溶液中:CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中:Cl-、HCO-3、SO2-4、NH+4
④由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br一
⑤有较多Fe3+的溶液中:Na+、H+、SCN-、HCO-3
⑥酸性溶液中:Fe2+、Al3+、NO-3、I-、Cl-.
A.①②
B.③⑥
C.②④
D.⑤⑥难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.71g氯气被还原得到的电子数为2NA
B.100mLlmol•L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C.标准状况下,2.24L苯中含有的碳原子数为0.6NA
D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64g金属时阳极失去的电子数小于2NA难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移难度: 中等查看答案及解析
-
下列除杂质的方法不可行的是( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.同温同压下,3molC2H2(g)和1molC6H6(g)的密度相等
B.非金属氧化物不一定是酸性氧化物,但大多数金属氧化物为碱性氧化物
C.具有相同分子数的甲酸甲酯与乙酸的共价键数相等
D.SO2、H2O2、活性炭都能使品红溶液褪色,但原理不同难度: 中等查看答案及解析
-
300mL 2mol/L 硝酸与一定量的铝镁铁合金反应生成 3.36L NO (标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入 3mol/L的NaOH 溶液,使铝镁铁元素恰好全部转化为沉淀,则所加 NaOH 溶液的体积是( )
A.150mL
B.200mL
C.450mL
D.无法计算难度: 中等查看答案及解析
-
下列实验装置设计正确,且能达到目的是( )
A.
实验室制氨气
B.
测定盐酸浓度
C.
从食盐水中提取NaCl
D.
石油的分馏难度: 中等查看答案及解析
-
下列有关实验的叙述中,合理的是( )
①用pH试纸测得氯水的pH为2 ②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可先将氯化铁溶解在盐酸中,再稀释到所需要的浓度.
A.②④⑥
B.②③⑥
C.①②④
D.②③④⑤⑥难度: 中等查看答案及解析
-
下列过程最终无沉淀产生的是( )
A.过量氨气通入Al2(SO4)3溶液
B.CO2通入CaCl2溶液
C.少量SO2通入BaCl2溶液后再通入过量Cl2
D.过量CO2通入Na2SiO3溶液难度: 中等查看答案及解析
-
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是( )
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si.
A.只有①③
B.只有②④
C.只有①②③④
D.①②③④⑤难度: 中等查看答案及解析
-
室温下,0.1mol/L的氨水溶液中,下列关系式中不正确的是( )
A.c(NH4+)>c>c(OH-)>c(H+)
B.c(OH-)>c(H+)
C.c+c(NH4+)+c(NH3)=0.1mol/L
D.c(OH-)=c(NH4+)+c(H+)难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )

A.实验室用装置①制取氨气
B.装置②中X若为苯,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可用于检验火柴头燃烧产生的SO2难度: 中等查看答案及解析
-
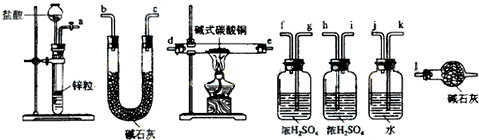
可用右图装置制取(必要时可加热)、净化、收集的气体是( )

A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢难度: 中等查看答案及解析
-
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶.其先后顺序正确的是( )
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①难度: 中等查看答案及解析
-
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中肯定不存在的离子组是( )
A.Al3+、Mg2+、I-、SO32-
B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I-
D.Al3+、CO32-、Br-、SO32-难度: 中等查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
A.7:4
B.7:3
C.7:2
D.7:1难度: 中等查看答案及解析