-
在相同状况下,将下列4组混合气体:①体积比为3:1的NH3和N2;②体积比为1:1的NO和NO2;③体积比为1:1的NO2和O2;④体积比为4:1的NO和O2分别置于完全相同的试管里,并倒置于水槽中,充分反应后,液面上升高度分别为h1、h2、h3、h4,则下列关系正确的是:
A.h1 > h2 > h3 > h4 B.h4 > h3 > h2 > h1
C.h4 > h1 > h3 > h2 D.h2 > h3 > h1 > h4
难度: 困难查看答案及解析
-
下列有关CuSO4溶液的叙述正确的是
A.通入CO2气体产生蓝色沉淀
B.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存
C.与H2S反应的离子方程式:Cu2++S2-=CuS↓
D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
难度: 简单查看答案及解析
-
下列由实验现象得出的结论正确的是
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色
Br-还原性强于Cl-
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结
NH4Cl固体可以升华
难度: 中等查看答案及解析
-
某金属单质跟一定浓度的硝酸反应,假定只有单一的还原产物,当参加反应的金属与被还原的HNO3的物质的量之比为2:1时,还原产物是
A.NO2 B.NO C.N2O D.N2
难度: 简单查看答案及解析
-
20.14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
A.9.6g B.6.4g C.3.2g D.1.6g
难度: 简单查看答案及解析
-
二氧化氮存在下列平衡:2NO2(g)
N2O4(g)(放热反应),在测定NO2的相对分子质量时,下列条件较为适宜的是
A.温度130℃、压强3.03×105Pa B.温度25℃、压强1.01×105Pa
C.温度0℃、压强5.05×104Pa D.温度130℃、压强5.05×104Pa
难度: 中等查看答案及解析
-
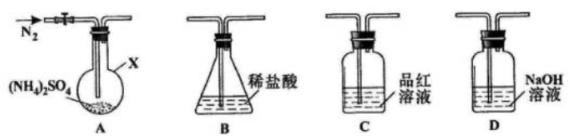
在通风棚中进行下列实验:
步骤
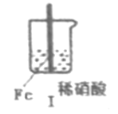
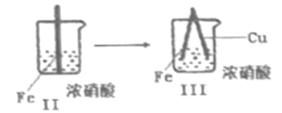
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面产生红棕色气泡
下列说法中不正确的是
A.I中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比I、II中现象,说明HNO3的氧化性强于浓HNO3
D.针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
难度: 中等查看答案及解析