-
NA为阿伏加德罗常数的值.下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.1 L 0.1 mol·L-1磷酸(H3PO4)溶液中含有的H+离子数为0.3NA
C.40g 34%的过氧化氢催化分解,生成0.1 mol氧气时转移的电子数为0.2NA
D.密闭容器中1mol NO与0.5 mol O2充分反应,产物的分子数为NA
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大,A、D同主族且D原子核电荷数等于A原子核电荷数的2倍,B、C原子的核外电子数之和与A、D原子的核外电子数之和相等.下列说法中一定正确的是( )
A.B的原子半径比A的原子半径小
B.A形成的氢化物分子中不可能含非极性键
C.B单质与水反应,水可能作氧化剂也可能作还原剂
D.C、D的最高价氧化物对应的水化物是酸
难度: 中等查看答案及解析
-
25℃、1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.7kJ·mol-1自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增大效应大于能量效应
难度: 中等查看答案及解析
-
电影《厉害了,我的国》通过镜头将我国在改革开放和社会主义现代化建设上所取得的历史性成就,进行了全方位、多层次的展现。下列说法不正确的是( )
A.我国自主研发的航空母舰装有大量的磁屏蔽材料K2NbO2F5,K2NbO2F5中所含元素均属于主族元素
B.大型客机C919机身表面涂有耐紫外线PMMA(聚甲基丙烯酸甲酯)材料,PMMA属于有机高分子化合物
C.DF-51弹道导弹是国之利器,其含有稀土金属钐(Sm),钐的活动性介于钠与铝之间,工业上可通过电解法制备钐
D.中国天眼为我国探究宇宙提供了强有力的保障,其中的防腐蚀材料磷酸钡属于强电解质
难度: 简单查看答案及解析
-
下列有关物质性质和用途说法正确的是( )
A.明矾、聚合氯化铝、聚合氯化铝铁等净水剂的净水原理都是利用金属阳离子水解形成胶体,能吸附水中悬浮物,达到净化水的目的
B.我国预计2020年发射首颗火星探测器,其自身携带的太阳能电池帆板的材料是二氧化硅晶体
C.今年是高铁提速年,高铁车厢采用铝合金材料制作,主要因为铝密度小、且常温下不与氧气反应
D.工业上可以使用铁制容器储运浓硫酸,是因为常温下,铁与浓硫酸不能反应
难度: 简单查看答案及解析
-
下列有关有机物的说法正确的是( )
A.苯、甲苯互为同系物,都能使酸性高锰酸钾褪色
B.二氯丁烷的同分异构体为8种(不考虑立体异构)
C.乙烯中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应
D.饱和硫酸铜和饱和硫酸铵都能使蛋白质溶液产生沉淀,其原理相同
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地壳中含量处于第二的元素,下列判断正确的是( )
X
Y
Z
W
A.原子半径:rW>rZ>rY>rX
B.X、Z元素的单质有多种
C.最简单气态氢化物的热稳定性:Z>W
D.Y的氧化物是酸性氧化物,不溶于任何酸
难度: 简单查看答案及解析
-
下列有关化学用语正确的是 ( )
A.NaOH的电子式:
B.I4O9(碘酸碘)中碘的化合价为+1、+5
C.NH5的结构与NH4Cl相似,NH5的结构式为
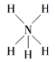
D.离子结构示意图
可以表示35Cl-,也可以表示37Cl-
难度: 中等查看答案及解析
-
氨硼烷(NH3·BH3)电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O,可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,已知H2O2足量,下列说法不正确的是( )
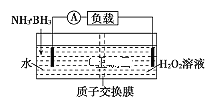
A.正极的电极反应式为3H2O2+6H++6e-═6H2O
B.H+通过质子交换膜向右侧移动
C.电池工作时,正、负极分别放出H2和NH3
D.当电路中转移0.6 NA电子,左右两极室质量差为1.9 g
难度: 简单查看答案及解析
-
25℃时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是( )
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.1 molNaN3所含阴离子总数为3NA
B.常温下,1L pH=1的H2SO4溶液和1L pH=1的NH4Cl溶液中由水电离的H+均为0.1NA
C.1mol
分子中最多共面的碳原子数为9NA
D.标准状况下,4.48L C12通入通入水中,转移的电子数为0.2NA
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(OH-)=1×10-13mol/L的溶液中:Mg2+、K+、SO42-、NO3-
B.
=1×10-10的溶液中:Na+、Cu2+、HCO3-、NO3-
C.0. 1 mol·L-1KNO3 溶液:H+、K+、SO42-、I-
D.0. 1 mol·L-1NaHS 溶液: H+、Na+、Cl-、SO42-
难度: 简单查看答案及解析
-
下列有关离子反应的说法正确的是( )
选项
离子方程式
评价
A
将2molCl2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2 = 2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+ 、I-均氧化
B
用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
H2↑+Cl2↑
正确;阳极氯离子放电,阴极氢离子放电
C
向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2一 + 4NH4++ 2H2O
正确;氨水过量,氢氧化铝能溶于过量的碱
D
将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
错误;电荷不守恒,生成物中应有亚铁离子
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
用下列所示装置不能达到有关实验目的的是( )
A.
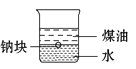 用该装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
用该装置证明密度ρ(煤油)<ρ(钠)<ρ(水)B.
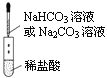 用该装置可检验HCO3-与CO32-结合H+的难易
用该装置可检验HCO3-与CO32-结合H+的难易C.
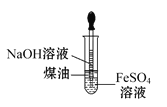 用该装置制备Fe(OH)2
用该装置制备Fe(OH)2D.
 该装置探究钢铁的吸氧腐蚀
该装置探究钢铁的吸氧腐蚀难度: 简单查看答案及解析
-
实验室制备硝基苯的反应装置如图所示,关于实验操作或叙述错误的是( )
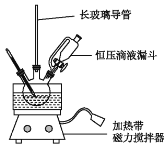
A.三颈烧瓶中的混合液的滴加顺序是苯、浓硝酸、浓硫酸
B.恒压滴液漏斗有利于液体顺利滴入三颈烧瓶中
C.加热装置可换成水浴加热
D.反应结束后三颈烧瓶中下层液体呈油状
难度: 简单查看答案及解析
-
SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
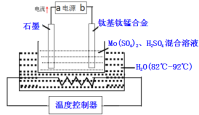
A.a极为电源的负极,发生氧化反应
B.电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2
C.钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+
D.电路中电子流向为:a极
石墨,钛基钛锰电极
b极
难度: 简单查看答案及解析
-
常温下向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是

A. a~c点,溶液中离子数目先增大后减小
B. b点溶液pH=7说明c(NH4+)=c(R-)
C. c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D. b、c两点对应溶液中,水的电离程度相同
难度: 中等查看答案及解析
-
一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
H2(g)+
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
难度: 中等查看答案及解析
-
25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法错误的是( )
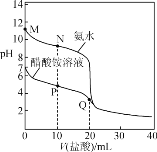
A.氨水的电离平衡常数的数量级约是10-5
B.N点:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点:c(NH4+)<2c(CH3COO-)+c(NH3·H2O)
D.Q点:2c(Cl-)=c(CH3COOH)+c(NH4+)
难度: 简单查看答案及解析
-
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)⇌cC(g)反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是 ( )
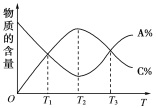
A.该反应在T1、T3温度时达到化学平衡
B.升高温度,平衡会向正反应方向移动
C.该反应的逆反应是放热反应
D.该反应在T2温度时达到化学平衡
难度: 简单查看答案及解析
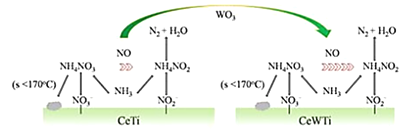
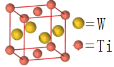
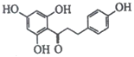 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下: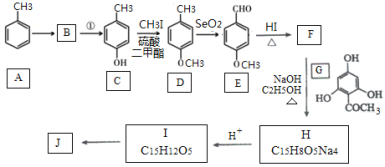
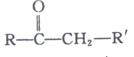 +R’’CHO
+R’’CHO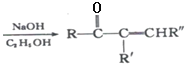 +H2O
+H2O