-
“保护环境”是我国的基本国策,下列做法应该提倡的是( )
A.燃烧含硫燃料 B.垃圾分类回收 C.露天焚烧秸秆 D.污水排入河流
难度: 中等查看答案及解析
-
下列化学用语表示正确的是( )
A.KIO3中I元素的化合价:-1
B.质子数为8,中子数为8的氧原子:
O
C.Cl-的结构示意图:
D.KClO3的电离方程式:KClO3=K++Cl-+3O2-
难度: 中等查看答案及解析
-
在水溶液中能大量共存的离子组是( )
A.Al3+、Mg2+、Cl- B.NH4+、K+、OH-
C.H+、SO42-、HCO3- D.Ca2+、Cl-、CO32-
难度: 中等查看答案及解析
-
下列有关物质的性质与用途对应关系正确的是( )
A.氧化铁能与酸反应,可制红色涂料
B.氢氧化铝具有弱碱性,可作胃酸中和剂
C.二氧化硅硬度大,可作光导纤维
D.小苏打能与碱反应,可作糕点焙制的膨松剂
难度: 中等查看答案及解析
-
下列反应既是分解反应,又是氧化还原反应的是( )
A.NH4HCO3
NH3↑+CO2↑+H2O
B.3Fe+2O2
Fe3O4
C.2C+SiO2
2CO+Si
D.NH4NO3
N2O↑+2H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.向铁粉中加入稀硝酸:Fe+2H+=Fe2++H2↑
D.向H2SO4溶液中加入Ba(OH) 2:H++OH-=H2O
难度: 中等查看答案及解析
-
下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)
2Na+Cl2↑ B.Fe3O4+4CO
3Fe+4CO2
C.Al2O3+2Fe
2Al+Fe2O3 D.2HgO
2Hg+O2↑
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CO2
CaCO3 B.Fe
FeCl3
C.CuO
Cu(OH)2 D.Al
Al(OH)3
难度: 中等查看答案及解析
-
下列四种气体中,与水无法做“喷泉”实验的是( )
A.HCl B.NH3 C.SO2 D.NO
难度: 中等查看答案及解析
-
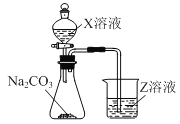
有两瓶无色溶液,一瓶为稀盐酸,一瓶为稀硝酸,能鉴别这两种溶液的合适试剂是( )
A.Na2CO3 B.AgNO3 C.NaOH D.BaCl2
难度: 中等查看答案及解析
-
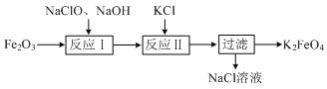
自来水厂常用ClO2对饮用水杀菌消毒,ClO2可通过以下反应制取2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O。下列说法正确的是( )
A.H2SO4是氧化剂 B.Na2SO3发生了还原反应
C.ClO2是还原产物 D.生成0.2molNa2SO4时转移电子数为0.4mol
难度: 中等查看答案及解析
-
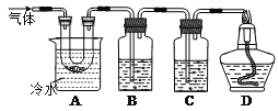
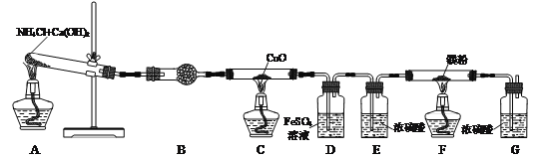
下列制取Cl2、净化、收集并验证某些性质的装置和原理能达到实验目的的是( )
A.制取Cl2
B.除去Cl2中的HCl
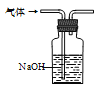
C.干燥Cl2
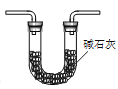
D.检验Cl2已集满
难度: 中等查看答案及解析
-
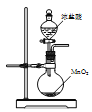
下列分离提纯的实验方法正确的是( )
A.
用图甲装置分离四氯化碳和水的混合物
B.
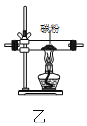 用图乙装置除去N2中混有的少量O2
用图乙装置除去N2中混有的少量O2C.
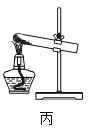 用图丙装置除去NaCl(含少量杂质NaHCO3)中的杂质
用图丙装置除去NaCl(含少量杂质NaHCO3)中的杂质D.
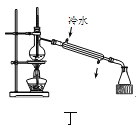 用图丁装置分离乙醇和水的混合物
用图丁装置分离乙醇和水的混合物难度: 中等查看答案及解析
-
一定条件下,20.00mL0.2mol·L-1的Na2Cr2O7溶液与30.00mL0.1mol·L-1的Na2S2O3恰好反应完全,生成了Cr3+和一种含硫物质,该含硫物质中硫元素的化合价是( )
A.-2 B.0 C.+4 D.+6
难度: 中等查看答案及解析
-
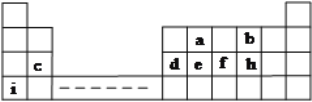
X、Y、Z、W、R属于周期表中前20号主族元素,且原子序数依次增大。元素X的单质是空气中体积分数最大的气体,Z是元素周期表中非金属性最强的元素,Z和W是同族元素,R的最外层电子数是最内层电子数的一半。下列说法正确的是( )
A.元素X和Y形成的化合物均为无色气体
B.元素Z、W的最高正价均为+7价
C.X的氢化物与W的氢化物相遇会生成白烟
D.化合物R2Y2中阳离子和阴离子比例为1∶1
难度: 中等查看答案及解析
-
根据实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向品红中通入SO2气体,溶液颜色褪去
SO2有强氧化性
B
将铜粉加入FeCl3溶液中,溶液变蓝
活泼性:Cu>Fe
C
向某溶液中加入Ca(OH)2溶液,出现白色沉淀
溶液中含CO32-
D
将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射微蓝色透明液体,有光亮的通路
微蓝色透明液体为胶体
A.A B.B C.C D.D
难度: 中等查看答案及解析