-
下列关于能量转换的认识中,不正确的是( )。
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
难度: 中等查看答案及解析
-
下列说法不正确的是( )。
A.原电池负极被氧化
B.任何化学反应都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
难度: 简单查看答案及解析
-
已知2SO2+O2
2SO3为放热反应,关于该反应的下列说法正确的是( )。
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热反应就可发生
难度: 中等查看答案及解析
-
下列反应条件的控制中不恰当的是( )。
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率,加入MnO2
D.为加快H2O2的分解速率,把反应容器放到冷水中冷却
难度: 中等查看答案及解析
-
在可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )。
A.升高温度 B.降低温度 C.使用催化剂 D.增大CO浓度
难度: 中等查看答案及解析
-
在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 中等查看答案及解析
-
一定条件下,可逆反应2A
B+3C,在下列四种状态中,处于平衡状态的是( )。
正反应速率 逆反应速率
A vA=2 mol·L-1·min-1 vB=2 mol·L-1·min-1
B vA=2 mol·L-1·min-1 vC=2 mol·L-1·min-1
C vA=1 mol·L-1·min-1 vB=2 mol·L-1·min-1
D vA=1 mol·L-1·min-1 vC=1.5 mol·L-1·min-1
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )。

A.化学方程式为:2M
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )。
A.用铜片、铅笔芯作电极插入稀硫酸中
B.用两个铜片作电极插入硝酸银溶液中
C.用锌片、铜片作电极插入番茄中
D.用铜片、铁片作电极插入酒精中
难度: 中等查看答案及解析
-
茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、PtFe合金网为电极材料的海水电池。在这种电池中( )。
①铝合金是阳极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应
A.②③ B.②④ C.①③ D.①④
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )。
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
难度: 中等查看答案及解析
-
一定温度下,反应2SO2(g)+O2(g)
2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+3Y2(g)
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1 B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1 D.c(Y2)=0.6 mol·L-1
难度: 中等查看答案及解析
-
如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是( )。
A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )。
①增加C的量 ②将容器的体积减小一半 ③保持体积不变,充入氮气使体系的压强增大 ④保持压强不变,充入氮气使体系的体积增大
A.①② B.②③ C.①③ D.③④
难度: 中等查看答案及解析
-
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
难度: 中等查看答案及解析
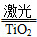 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题: