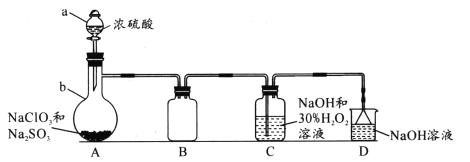
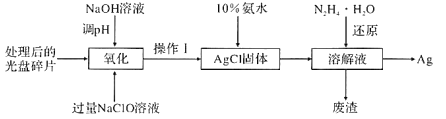
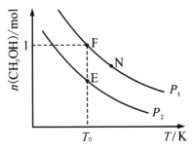
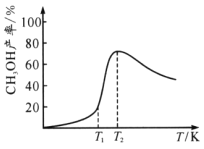
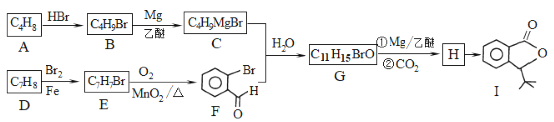
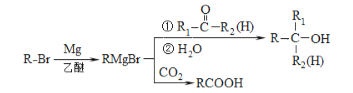
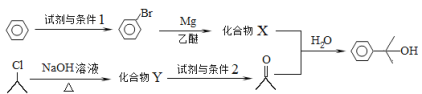
-
主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是( )
A. 原子半径:T>R>W>Z
B. T和R形成化合物的水溶液呈碱性
C. 化合物TX具有很强的还原性,可与水反应
D. T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
难度: 中等查看答案及解析
-
2019年北京园艺会主题是“绿色生活,美丽家园”。下列有关园艺会说法正确的是( )
A. 大会交通推广使用的是利用原电池原理制成太阳能电池汽车,可减少化石能源的使用
B. 妫汭剧场里使用的建筑材料第五形态的碳单质——“碳纳米泡沫”,与石墨烯互为同分异构体
C. 传统烟花的制作常加入含有铂、铁、钾、钙、铜等金属元素的发光剂,燃放时呈现美丽的颜色,大会庆典禁止使用
D. 秸秆经加工处理成吸水性的材料——植物纤维,可用作食品干燥剂,符合大会主题
难度: 中等查看答案及解析
-
某有机物的结构为
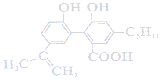 ,下列说法正确的是( )
,下列说法正确的是( )A. 1 mol该有机物最多可以与7 mol H2发生加成反应
B. 该有机物可以发生取代、加成、氧化、水解等反应
C. 0.1 mol该有机物与足量金属钠反应最多可以生成3.36L H2
D. 与该有机物具有相同官能团的同分异构体共有8种(不考虑立体异构)
难度: 中等查看答案及解析
-
用下列装置能达到实验目的的是
A.
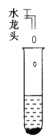 清洗铜与浓硫酸反应后有残液的试管
清洗铜与浓硫酸反应后有残液的试管B.
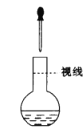 配置一定物质的量浓度的溶液实验中,为定容时的操作
配置一定物质的量浓度的溶液实验中,为定容时的操作C.
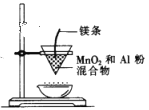 装置制取金属锰
装置制取金属锰D.
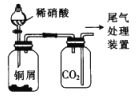 装置为制备并用排气法收集NO气体的装置
装置为制备并用排气法收集NO气体的装置难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。上述物质有如图转化关系:
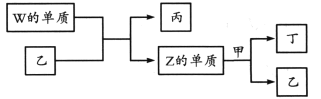
下列说法错误的是
A.四种元素形成的单质中W的氧化性最强
B.甲、乙、丙中沸点最高的是丙
C.甲常用作致冷剂
D.甲、乙分子均只含极性共价键
难度: 中等查看答案及解析
-
已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。
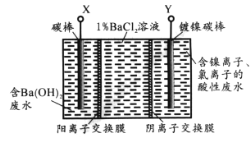
下列分析正确的是
A.X与电池的Li电极相连
B.电解过程中c(BaC12)保持不变
C.该锂离子电池正极反应为:FeS+2Li++2e− =Fe +Li2S
D.若去掉阳离子膜将左右两室合并,则X电极的反应不变
难度: 中等查看答案及解析