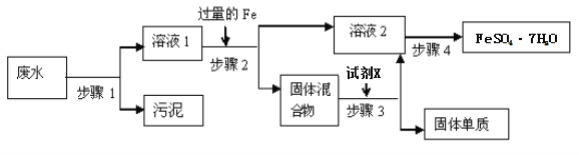
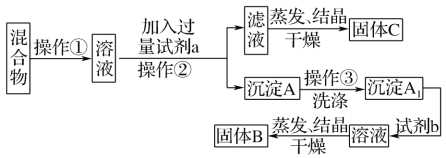
-
电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中。假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是( )
A. 过滤 B. 萃取 C. 蒸发 D. 蒸馏
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 1 mol NH4+的质量为18 g B. SO2的摩尔质量为64 g·mol-1
C. 摩尔是描述物质所含微粒多少的物理量 D. 一个水分子的质量约等于18/(6.02×1023 )g
难度: 简单查看答案及解析
-
下列关于2 mol·L-1 Ba(NO3)2溶液的说法正确的是
A. 100 mL溶液中NO3- 浓度是0.4 mol·L-1
B. 500 mL溶液中NO3- 的物质的量是4 mol
C. 500 mL溶液中含有Ba2+ 的质量是137 g
D. 100 mL溶液中所含Ba2+、NO3-总数为0.4 NA
难度: 简单查看答案及解析
-
某地无色透明水样中可能大量存在以下离子中的一种或几种:H+、Na+、Ba2+、Mg2+、Cu2+、Cl-、CO32-、OH-,某化学兴趣小组为了测定其成分做了如下实验:向水样中滴入石蕊试液,溶液变成蓝色;另取一份水样,向其中滴入过量的稀盐酸,产生大量气泡。由此可以得出水样中
A. 一定没有H+、Mg2+、CO32-、Cu2+
B. 可能存在Cl-、Na+、Mg2+,一定不存在Cu2+
C. 一定存在H+、Na+、OH-
D. 一定存在Na+、CO32-、OH-,可能存在Cl-
难度: 简单查看答案及解析
-
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为
A.0.1 mol/L B.0.2 mol/L
C.0.3 mol/L D.0.4 mol/L
难度: 中等查看答案及解析
-
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
难度: 中等查看答案及解析
-
下列有关实验操作正确的是( )
A.
 B.
B.
C.
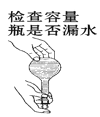 D.
D.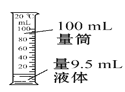
难度: 简单查看答案及解析
-
下列实验操作中正确的是( )
A.用水分离四氯化碳和酒精的混合物
B.蒸馏完毕时,先再停止加热,关闭冷凝水
C.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸 馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
D.将放在称量纸上称取的NaOH固体在烧杯中溶解,待冷却后,再转移至容量瓶
难度: 简单查看答案及解析
-
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划分为同一类物质,下列分类标准正确的是
①钠的化合物 ②能与硝酸反应的物质 ③电解质 ④钠盐 ⑤钠的含氧化合物
A.①④ B.③④ C.②⑤ D.①③
难度: 简单查看答案及解析
-
4克氧气含有x个氧原子,则阿伏加德罗常数为
A.x/4 B.4x C.x/8 D.8x
难度: 简单查看答案及解析
-
下列各溶液中,Na+物质的量浓度最大的是( )
A.4 L、0.5 mol·L-1NaCl溶液 B.1 L、0.3 mol·L-1Na2SO4溶液
C.5 L、0.4 mol·L-1NaOH溶液 D.2 L、0.15 mol·L-1、Na3PO4溶液
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 直径介于1~100
之间的微粒称为胶体
B.
胶体是纯净物
C. 利用丁达尔现象可以区别溶液和胶体
D. 胶体粒子很小,可以透过半透膜
难度: 简单查看答案及解析
-
现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质
熔点/ ℃
沸点/ ℃
密度/ g·cm−3
水中的溶解性
甲
-98
57.5
0.93
可溶
乙
-84
77
0.90
可溶
据此,将甲和乙互相分离的方法是
A. 蒸馏法 B. 升华法 C. 萃取法 D. 过滤法
难度: 简单查看答案及解析
-
某溶液中含有大量的 Cl-、CO32-、SO42-等三种阴离子。如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加 HNO3 溶液 ②过滤 ③滴加 AgNO3 溶液 ④滴加 Ba(NO3)2 溶液
A. ①④②③ B. ④②①③ C. ③②①④ D. ④②③②①
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4LH2O的分子数为NA
B.1molOH-所含质子数为10NA
C.物质的量浓度为0.5mol·L-1的MgCl2溶液,含有的Cl-数为NA
D.常温常压下,32gO2和O3的混合气体所含原子数为2NA
难度: 中等查看答案及解析
-
完成下列实验所需选择的装置或仪器都正确的是
选项
A
B
C
D
实验
分离植物油和氯化钠溶液
除去氯化钠固体中混有的碳酸钙固体
分离CCl4中的Br2
除去CO2气体中的HCl气体
装置或仪器
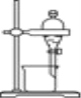
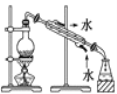

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在下列条件下,两瓶气体所含的原子数一定相等的是( )
A.具有同压强、同体积的N2O和CO2
B.具有同温度、同体积的CO和N2
C.具有同体积、同密度的SO2和NO2
D.常温常压下28gN2和1molO2所含原子数
难度: 困难查看答案及解析
-
下列反应中,离子方程式不正确的是( )
A.CuO与稀硫酸反应:CuO+2H+=Cu2++H2O
B.大理石与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.稀HNO3与Ba(OH)2溶液反应:H++OH-=H2O
D.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
难度: 简单查看答案及解析
-
下列离子能大量共存的是( )
A.无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B.无色透明的溶液中:Cu2+、K+、SO42-、NO3-
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl-
D.紫色石蕊试液呈蓝色的溶液中:Ca2+、K+、HCO3-、NO3-
难度: 中等查看答案及解析
-
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则混合气体中CO2、H2和CO的体积比为( )
A.29:8:13 B.22:1:14 C.13:8:29 D.26:8:57
难度: 中等查看答案及解析
-
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含mmolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含nmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的物质的量浓度为( )
A.
mol/L B.
mol/L C.
moI/L D.
mol/L
难度: 中等查看答案及解析