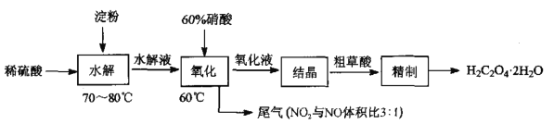
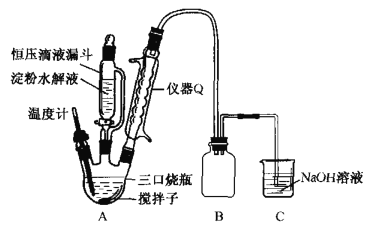
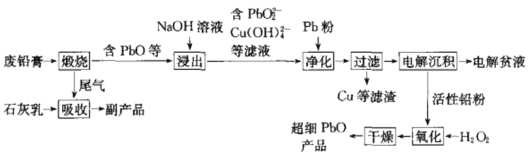
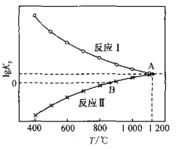
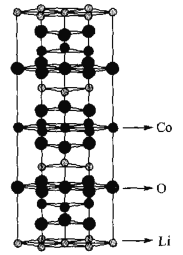
-
下列物质的用途是利用其物理性质的是
选项
物质
用途
A
四氢噻吩(
)
作为杂质气体添加到家用天然气中,警示气体泄漏
B
铁粉
装入透气纸袋中,用于富脂食品包装袋中
C
KMnO4
浸泡硅藻土,用作新鲜水果的保鲜剂
D
K2Cr2O7
用于酒驾检测仪中,检验司机是否酒驾
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.1 mol-OH与0. 1mol OH-含电子数均为NA
B.7 g乙醛与4g乙酸乙酯混合物中含C-H键总数为NA
C.32.5 g FeCl3水解生成的Fe(OH)3胶体粒子数为0.2 NA
D.标准状况下,2.24L N2和O2的混合气中分子数为0. 2 NA
难度: 简单查看答案及解析
-
通过下列装置可探究Cu2S(黑色)与O2的反应产物。下列说法错误的是
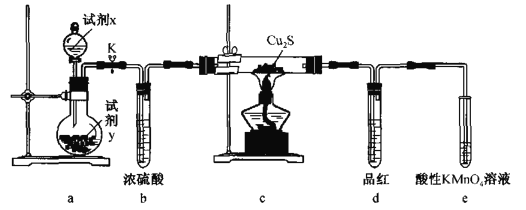
A.试剂x、y可分别选用H2O、Na2O2 B.b、d的作用分别是干燥O2、检验SO2
C.若c中固体变红色,说明生成物为金属铜 D.e中酸性KMnO4溶液可用NaOH溶液替代
难度: 中等查看答案及解析
-
某有机物(1.2,4,5一Tetrakis(methylene) spiro[2.2]pentane}的结构如图所示,下列说法错误的是
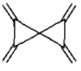
A.分子中所有碳原子不可能共面 B.该有机物的一氯代物只有1种
C.与
互为同分异构体 D.能使溴的四氯化碳溶液褪色
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,W、X、Y最外层电子数之和等于11,W、X、Y三种元素形成的化合物水溶液可用作木材防火剂。下列说法错误的是
A.四种元素中X的原子半径最大
B.W分别与X、Y、Z均能形成二元化合物
C.Y的简单氢化物的热稳定性比Z的弱
D.X、Z的简单离子均能破坏水的电离平衡
难度: 简单查看答案及解析
-
一种铝离子二次电池装置如图所示,己知其放电时正极反应为MoS2+3xe—+4xAl2Cl7—=AlxMoS2+7xAlCl4—。下列说法正确的是
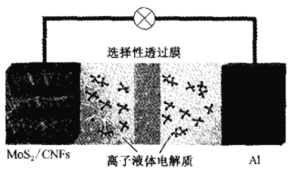
A.放电时,MoS2/CNFs电极上发生氧化反应
B.放电时,负极反应为Al+7A1Cl4——3e-=4A12C17—
C.充电时,AlC14—向阴极迁移,Al2Cl7—向阳极迁移
D.充电时,Al极的电势比MoS2 /CNFs极的电势高
难度: 中等查看答案及解析
-
室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
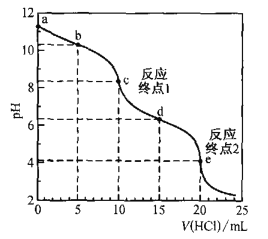
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
难度: 困难查看答案及解析