-
25 ℃时,某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法不正确的是( )
A.可能由pH=2的盐酸与pH=12的氨水等体积混合而成
B.该溶液可能由等物质的量浓度的盐酸和氨水等体积混合而成
C.加入适量氨水,溶液中离子浓度可能为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.该溶液中c(NH4+)=c(Cl-)+c(OH-)-c(H+)
难度: 中等查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
难度: 中等查看答案及解析
-
某元素简化电子排布式为[Xe]4f46s2,其应在( )
A.s区 B.p区 C.d区 D.f区
难度: 简单查看答案及解析
-
下列物质的水溶液中,所含微粒种类最多的是( )
A.NH3 B.Cl2 C.H2SO4 D.NaOH
难度: 简单查看答案及解析
-
下列有利于反应自发进行的是( )
①反应吸热 ②反应放热 ③反应后熵增加 ④反应后熵减小
A.①③ B.②③ C.②④ D.①④
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 离子晶体中一定含离子键,不可能会有共价键
B. 离子晶体一定由酸根离子和金属离子组成的
C. 离子晶体晶格能越大,熔点越高,硬度越大
D. 金属晶体采取非密堆积时的空间利用率相等
难度: 中等查看答案及解析
-
心脏起搏器电源—锂碘电池反应为:2Li(s)+I2(s)=2LiI(s)ΔH;已知:4Li(s)+O2(g)=2Li2O(s)ΔH1;4LiI(s)+O2(g)=2I2(s)+2Li2O(s)ΔH2;则下列说法正确的是( )
A.ΔH=1/2ΔH1-ΔH2 B.ΔH=1/2ΔH1+ ΔH2
C.ΔH=12/ΔH1-1/2ΔH2 D.ΔH=1/2ΔH1+ 1/2ΔH2
难度: 简单查看答案及解析
-
CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角,下列关于晶体的说法,一定正确的是( )。

A.分子晶体中都存在共价键
B.如上图,CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
难度: 中等查看答案及解析
-
有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A.D原子的简化电子排布式为[Ar]3s23p4
B.B、C两元素的第一电离能大小关系为B>C
C.用电子式表示AD2的形成过程为
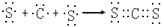
D.由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
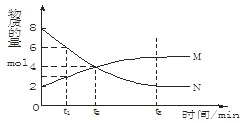
下列表述中正确的是
A.反应的化学方程式为: M
N B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)
C(g)+D(g),5 min后达到平衡。若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
A. a=2 B. a=1 C. a=3 D. 无法确定a的值
难度: 中等查看答案及解析
-
把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(g)
xC(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol· (L·s)-1,同时生成1 mol D,下列叙述中错误的是( )
A. 达到平衡状态时A的转化率为50%
B. x=4
C. 达到平衡状态时容器内气体的压强与起始时压强比为6∶5
D. 5 s内B的反应速率v(B)=0.05 mol · (L·s)-1
难度: 中等查看答案及解析
-
下列有关金属腐蚀的说法中正确的是
①金属的腐蚀全部是氧化还原反应
②金属的腐蚀可分为化学腐蚀和电化学腐蚀,只有电化学腐蚀才是氧化还原反应
③因为二氧化碳普遍存在,所以钢铁的电化学腐蚀以析氢腐蚀为主
④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化
A. ①③ B. ②③ C. ①④ D. ①③④
难度: 中等查看答案及解析
-
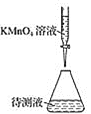
某学生用如图所示的装置对能量变化情况进行研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。不符合要求的X、Y可能是( )
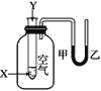
A.X是水,Y是浓硫酸
B.X是盐酸,Y是氢氧化钠溶液
C.X是硝酸铵固体,Y是水
D.X是铝粉,Y是稀硫酸
难度: 中等查看答案及解析
-
某温度下,在密闭容器中进行SO2的催化氧化反应。若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则下列叙述中正确的是
A.SO2的转化率为60%
B.SO3的产率为60%
C.平衡时总压强与起始压强之比为7∶8
D.平衡时V(SO2):V(O2):V(SO3)=3∶3∶1
难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断下列说法正确的是( )
A.在冰醋酸中这四种酸都完全电离
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H+ +SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
难度: 中等查看答案及解析
-
反应2A(g)+B(g)
2C(g) △H>0。下列反应条件有利于生成C的是
A.低温、低压 B.低温、高压
C.高温、高压 D.高温、低压
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.相同温度下,饱和溶液的导电性一定比不饱和溶液的导电性强
B.Na2O的水溶液能导电是因为Na2O与水反应生成的NaOH发生电离,所以NaOH是电解质,Na2O是非电解质
C.强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
D.难溶于水的物质不一定是弱电解质
难度: 中等查看答案及解析
-
在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2 B.1∶3 C.2∶3 D.3∶2
难度: 中等查看答案及解析
-
电子数相等的微粒叫等电子体,下列各组微粒属于等电子体的是
A.NO和NO2 B.C2H4和N2
C.NH4+和OH﹣ D.NO和CO2
难度: 简单查看答案及解析
-
在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是( )
A.原子晶体干冰易汽化,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.1 mol原子晶体干冰中含2 mol C—O键
难度: 中等查看答案及解析
-
现在科学家正在寻求将太阳能转化成化学能的办法,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其他能源。如图是有关的能量循环示意图,下列有关说法正确的是( )

A.图中ΔH1=ΔH2+ΔH3
B.如果H—H的键能为akJ·mol-1,O=O键能为bkJ·mol-1,则断开1 mol H—O键所需要的太阳能为(ΔH1+a+b) kJ
C.1 mol H2燃烧生成液态水放出|ΔH3| kJ的热量
D.水蒸气所具有的能量比液态水多ΔH2kJ
难度: 中等查看答案及解析
-
有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂效率都很低
B.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是20~50 MPa,因为该压强下铁触媒的活性最大
难度: 中等查看答案及解析
-
在容积为4 L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)⇌2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如图。则图中阴影部分的面积表示( )

A.X的浓度的变化 B.Y的物质的量的变化
C.Z的浓度的变化 D.Z的物质的量的减少
难度: 中等查看答案及解析
 b.
b.