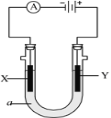-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A. 反应混合物的浓度 B. 反应体系的压强
C. 正、逆反应的速率 D. 反应物的转化率
难度: 简单查看答案及解析
-
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生反应
难度: 简单查看答案及解析
-
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
A. 利用电池外壳的金属材料
B. 回收其中石墨电极
C. 防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D. 不使电池中泄漏的电解液腐蚀其他物品
难度: 简单查看答案及解析
-
在一密闭容器中进行反应2SO2+O2⇌2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L
D.SO3为0.4mol/L
难度: 中等查看答案及解析
-
可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e-=2Br- ②2Br-—2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn其中表示正极反应和负极反应的分别是( )
A.①和③ B.②和① C.③和① D.④和①
难度: 中等查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是
A.②④ B.③④ C.②⑤ D.①⑤
难度: 中等查看答案及解析
-
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤V2
难度: 中等查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s)△H= —701.0kJ·mol-1 ,2Hg(l)+O2(g)=2HgO(s)△H= —181.6kJ·mol-1,则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为( )
A. -259.7 kJ·mol-1 B. +259.7 kJ·mol-1 C. +519.4kJ·mol-1 D. -519.4kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 可逆反应的特征是正反应速率和逆反应速率相等
B. 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C. 在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D. 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
难度: 中等查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vc=2vB,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
难度: 简单查看答案及解析
-
化学电池可以直接将化学能转化为电能,化学电池的本质是
A. 化合价的升降 B. 电子的转移 C. 氧化还原反应 D. 电能的储存
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
难度: 简单查看答案及解析
-
设C+CO2
2CO-Q1(吸热反应)反应速率为v1,N2+3H2
2NH3+Q2(放热反应)反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.增大,减小 D.减小,增大
难度: 简单查看答案及解析
-
溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.010 mol·L-1。向该溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是[已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,Ksp(AgI)=8.3×10-17]( )
A.AgBr和AgI B.AgI和AgCl
C.AgBr和AgCl D.一起沉淀
难度: 简单查看答案及解析
-
对于0.1mol·L-1Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3-)+ c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
难度: 中等查看答案及解析
-
物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( )
A.KX、KZ、KY B.KX、 KY、KZ
C.KZ、KY 、KX D.KY、KZ、KX
难度: 简单查看答案及解析
-
在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=c B. 该变化使平衡正向移动
C. B的转化率降低 D. C的体积分数增大
难度: 困难查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A.

B.
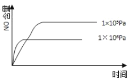
C.
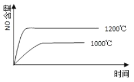
D.

难度: 中等查看答案及解析