-
设NA表示阿伏加德罗常数,下列叙述正确的是
A.在密闭容器中加入0.5moLN2和1.5moLH2,充分反应后容器中的N—H键数为3NA
B.标准状况下,2.24 LHF中含有的原子数为0.2 NA
C.71 g氯气与足量铁反应得到的电子数一定为2NA
D.电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3ˉ+2OHˉ=CaCO3↓+CO32ˉ+2H2O
B.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3ˉ+2OH-
NH3↑+SO32ˉ+2H2O
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性: H++SO42ˉ+Ba2++OHˉ=BaSO4↓+H2O
D.向KIO3与KI混合溶液中加入醋酸发生反应生成I2:IO3ˉ+5Iˉ+6H+=3I2+3H2O
难度: 中等查看答案及解析
-
A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是

A.若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子
B.反应②的离子方程式为MnO2+4H++2Clˉ
Mn2++2H2O+Cl2↑
C.新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D.已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
难度: 困难查看答案及解析
-
含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子或物质沉淀pH见下表)
离子
Mg2+
Al 3+
物质
Al(OH)3
开始沉淀pH
8.93
3.56
开始溶解pH
8.04
完全沉淀pH
10.92
4.89
完全溶解pH
12.04

难度: 困难查看答案及解析
-
一定条件下存在反应:H2(g) + I2(g)
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子。下列说法正确的
A.四种元素中有两种元素在第二周期
B.W所在主族元素的原子次外层电子数可能为2或8,不可能为18
C.X、Y、Z的最高价氧化物对应的水化物两两之间能反应
D.工业上获得X、Y单质的方法主要是电解其熔融的氯化物
难度: 中等查看答案及解析
-
电化学降解NO3-的原理如图所示。下列说法中不正确的是
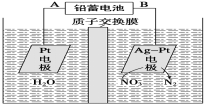
A.铅蓄电池的A极为正极,电极材料为PbO2
B.铅蓄电池工作过程中负极质量增加
C.该电解池的阴极反应为:2NO3-+ 6H2O + 10eˉ = N2↑ + 12OHˉ
D.若电解过程中转移2moL电子,则交换膜两侧电解液的质量变化差(Δm左-Δm右)为10.4g
难度: 中等查看答案及解析