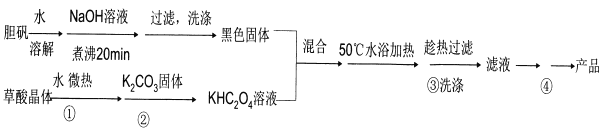
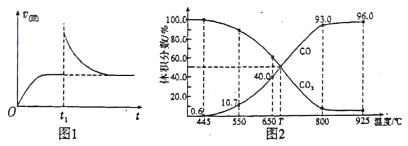
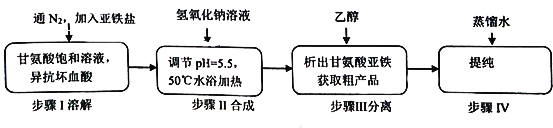
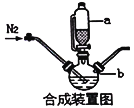
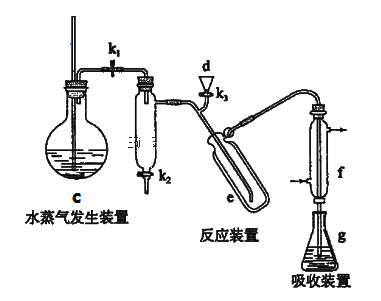
-
如表实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体通入苯酚钠溶液中
苯酚钠溶液产生浑浊
酸性:醋酸>碳酸>苯酚
B
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置
下层溶液显紫红色
氧化性:Fe3+>I2
C
向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L-1FeCl3溶液
白色沉淀转化为红褐色沉淀
相同温度下的KspMg(OH)2>KspFe(OH)3
D
室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH
CH3COONa溶液的pH试纸颜色深
酸性:HClO>CH3COOH
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
“中国名片”中航天、军事、天文等领域的发展受到世界瞩目,它们与化学有着密切的联系。下列说法错误的是( )
A.“中国天眼”用到的钢铁属于黑色金属材料
B.“歼-20”飞机上大量使用的碳纤维是一种新型有机高分子材料
C.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
D.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.CO2通过Na2O2使其增重a g时,反应中转移的电子数为a/28NA
B.60gSi02中含Si—O键的个数为2NA
C.10g49%的硫酸与10g49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
难度: 中等查看答案及解析
-
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图。下列有关说法中正确的是( )
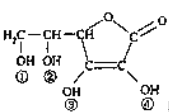
A.维生素C的分子式为C6H8O6
B.维生素C由于含有酯基而难溶于水
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C的酸性可能是①、②两个羟基引起的
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
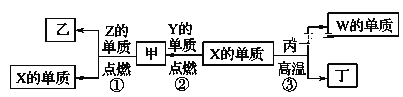
A.反应③可用于工业上制取W的单质
B.X位于元素周期表第二周期ⅣA族
C.非金属性:X>W
D.工业上通过电解乙来制取Z的单质
难度: 中等查看答案及解析
-
已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法错误的是

A.电极Y应为Li
B.X极反应式为FeS+2Li++2e-=Fe+Li2S
C.电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析
-
常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的c(H+)与NaOH溶液的体积之间的关系如图所示,下列推断正确的是

A.用pH试纸测定E点对应溶液,其pH = 3
B.H、F点对应溶液中都存在:c(Na+) = c(Cl-) + c(ClO-)
C.G 点对应溶液中:c(Na+) >c(Cl-) >c(ClO-)>c(OH-) >c(H+)
D.常温下加水稀释H点对应溶液,溶液的pH增大
难度: 困难查看答案及解析