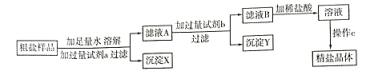
-
我国古代的有关典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是4Ag+2H2S+O2═2X+nH2O.下列有关该反应的说法不正确的是( )
A. n=2 B. 该反应中只有银是单质
C. X的化学式是Ag2S D. 该反应是氧化反应
难度: 中等查看答案及解析
-
以下叙述正确的是( )
A. 由同种元素组成的纯净物叫单质
B. 由两种或两种以上的元素组成的物质叫混合物
C. 石油是一种纯净物
D. 合金都是化合物
难度: 中等查看答案及解析
-
类推的思维方式在化学的学习中经常用到。以下类推的结论正确的是( )
A.离子是带电的原子或原子团,带电的原子或原子团不一定是离子。
B.中和反应有盐和水生成,所以生成盐和水的化学反应一定是中和反应。
C.氧化物含有氧元素,含有氧元素的化合物一定是氧化物。
D.碱溶液一定呈碱性,呈碱性的溶液不一定是碱溶液。
难度: 中等查看答案及解析
-
铝元素和氯元素在元素周期表中的有关信息如图所示,下列相关说法正确的是
A. 铝是人体内含量最多的金属元素
B. 铝原子核内有13个质子
C. 氯原子的质量是35.45
D. 这两种元素组成的化合物化学式为AlCl2
难度: 简单查看答案及解析
-
下列反应中,属于缓慢氧化的是( )
A.煤燃烧 B.食物腐败
C.光合作用 D.加热碳酸氢铵
难度: 简单查看答案及解析
-
生物体中含有多种氨基酸(结构如图所示)。下列有关叙述正确的( )
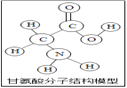
A. 甘氨酸是有机高分子化合物
B. 一个甘氨酸分子中含有10个原子
C. 甘氨酸是由碳、氢、氧、氮四种原子构成的
D. 甘氨酸中碳元素与氧元素的质量比为1:1
难度: 中等查看答案及解析
-
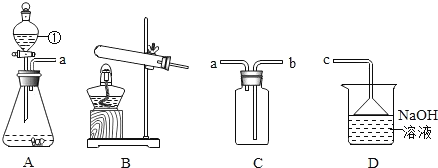
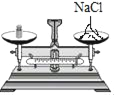
学生具备化学实验技能是进行科学探究活动的基础和保证。下列图示实验操作中正确的是( )
A.称量固体
 B.检验H2的纯度
B.检验H2的纯度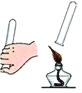
C.倾倒液体
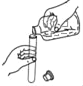 D.测溶液的pH
D.测溶液的pH
难度: 简单查看答案及解析
-
2018年3月5日,国务院总理李克强在十三届全国人大一次会议上作政府工作报告时强调,我们要携手行动,建设天蓝、地绿、水清的美丽中国。下列说法正确的是( )
A.工业城市的细颗粒物(PM2.5)浓度可以超标。 B.严禁“洋垃圾”入境。
C.居民生活中可以使用含磷洗衣粉。 D.为了保证用餐卫生,提倡使用一次性筷子。
难度: 简单查看答案及解析
-
下列归类错误的是( )
选 项
归 类
内 容
A
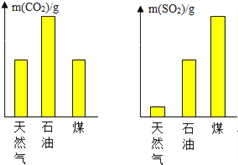
化石燃料
煤、石油、天然气
B
常见合金
黄铜、硬铝、玻璃钢
C
同一物质
烧碱、火碱、苛性钠
D
糖类物质
淀粉、蔗糖、纤维素
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
20℃时分别取甲、乙、丙、丁四种纯净物各20g,分别加入到四个盛有50g水的烧杯中,充分溶解,其溶解情况如下表:
物质
甲
乙
丙
丁
未溶解固体的质量
4.2
2
0
9.2
下列说法正确的是
A.所得四杯溶液都是饱和的 B.四种物质溶解过程中都放热
C.丁溶液的溶质质量分数最大 D.20℃时,四种溶质的溶解度关系是:丙>乙>甲>丁
难度: 简单查看答案及解析