-
下列说法正确的是
①需要加热方能发生的反应一定是吸热反应
②化学反应的发生一定会伴随能量变化
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④旧化学键的断裂说明- 一定发生了化学反应
A. ③④ B. ①② C. ②③ D. ②③④
难度: 中等查看答案及解析
-
下列不能说明氯元素的非金属性比硫元素强的事实是
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A. ②⑤ B. ①② C. ①②④ D. ①③⑤
难度: 中等查看答案及解析
-
2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用
Ca轰击
Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A.第117号元素是副族元素 B.
Bk的质量数为97
C.第117号元素是非金属元素 D.
Ca2+的中子数比核外电子数多10
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.在周期表中,族序数都等于该族元素的最外层电子数
B.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
C.卤素单质随原子序数的增大,其熔沸点逐渐降低
D.碱金属随原子序数的增大,其熔沸点逐渐降低
难度: 简单查看答案及解析
-
铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A.溶于水加硝酸银溶液,观察是否有白色沉淀生成
B.溶于水做导电实验,观察是否导电
C.熔融状态,做导电实验,观察是否导电
D.测定氯化铍熔点
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子比为1:1的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.O2分子间存在着非极性共价键 B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物 D.盐酸中含有H+和Cl-,故HCl为离子化合物
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A.氯离子的结构示意图:
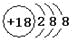
B.作为相对原子质量测定标准的碳核素:
C
C.氯化镁的电子式:
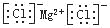
D.用电子式表示氯化氢分子的形成过程:

难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子序数之差为2的两种元素不可能位于同一主族
B.D-核外有36个电子 ,则元素D位于第四周期第ⅦA族
C.位于同一主族相邻的甲、乙两种元素,甲的原子序数为
,则乙的原子序数可能为
D.位于同一周期的甲、乙两种元素,甲位于第IIA族,原子序数为
,乙位于第ⅢA族,则乙原子序数可能为
难度: 中等查看答案及解析
-
下列各组中每种物质都既有离子键又有共价键的一组是 ( )
A.
、
、
B.
、
、
C.
、
、
D.
、
、
难度: 简单查看答案及解析
-
X、Y、Z、W四种短周期主族元素的原子序数依次增大。X、Y原子的最外层电子数之比为2∶3,Z+与Y2-核外电子排布完全相同,常温下,W的一种单质为淡黄色固体。下列说法不正确的是( )
A.离子半径:W>Z>Y
B.简单气态氢化物的热稳定性:Y>W
C.Y分别与X、Z、W能形成两种或两种以上的化合物
D.Z与Y、W分别形成的化合物溶于水,溶液均呈碱性
难度: 中等查看答案及解析
-
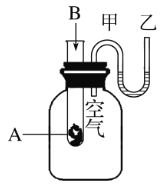
关于化学能与其他能量相互转化的说法正确的是( )
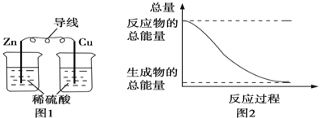
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
难度: 中等查看答案及解析
-
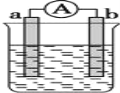
如图是课外活动小组设计的用化学电源使LED灯发光装置。下列说法不正确的是( )
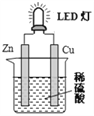
A. 锌是负极,电子从锌片经导线流向铜片
B. 铜片表面有气泡生成
C. 如果将硫酸换成橙汁,导线中不会有电子流动
D. 装置中存在“化学能→电能→光能”的转换
难度: 简单查看答案及解析
-
下列关于化学能转化为电能的四种装置的说法正确的是

A.电池Ⅰ中锌是正极
B.电池Ⅱ是一次性电池
C.电池Ⅲ工作时,氢气发生还原反应
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
难度: 中等查看答案及解析
-
下列说法正确的是
A.硅原子比碳原子的半径小
B.SiH4、PH3、H2S、HCl的热稳定性依次减弱
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强
D.Cl、Br、I的最高价氧化物对应水化物都显酸性,而且酸性从上到下依次增强
难度: 简单查看答案及解析
-
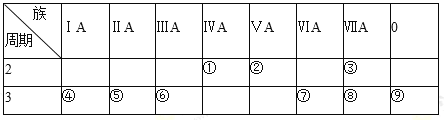
如图所示,A、B、C、D、E是元素周期表中的5种主族元素。下列说法不正确的是( )
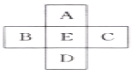
A.A、E原子序数之差可能为2 B.D、E原子序数之差可能为18或32
C.B、C原子序数之差一定是2 D.B、D原子序数之差不可能是7
难度: 中等查看答案及解析
-
下列关于化学键的叙述正确的是
A.非金属元素组成的化合物中只含共价键
B.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键。
C.不同元素的原子构成的分子只含极性共价键
D.CH4中所有的价电子都参与形成共价键
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为
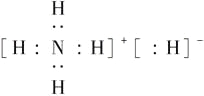
D.它与水反应的化学方程式为NH5+H2O=NH3·H2O+H2↑
难度: 中等查看答案及解析