-
下列说法正确的是 ( )
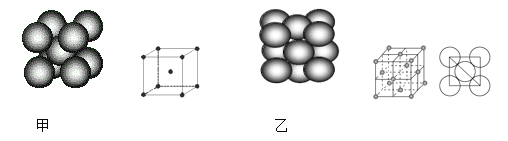
A.124g P4含有的P-P键的个数为6NA
B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA
D.60gSiO2中含Si-O键的个数为2NA
难度: 中等查看答案及解析
-
下列物质的熔、沸点高低顺序中,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O D.金刚石>生铁>纯铁>钠
难度: 简单查看答案及解析
-
某基态原子第四电子层只有2个电子,该原子的第三电子层电子数可能有
A.8 B.18 C.8~18 D.18~32
难度: 简单查看答案及解析
-
下列各组指定的元素,不能形成AB2型化合物的是
A.2s22p2和2s22p4 B.2s22p2和3s23p4
C.3s2和3s23p5 D.3s1和3s23p5
难度: 简单查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH<Mg(OH)2<Al(OH)3 B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al D.还原性:Na>Mg>Al
难度: 中等查看答案及解析
-
下列有关晶体的叙述正确的是
A.金属晶体含有金属阳离子和自由电子
B.原子晶体一定是单质
C.分子晶体一定是化合物
D.金属晶体的硬度>原子晶体的硬度>分子晶体的硬度
难度: 简单查看答案及解析
-
第四周期元素原子中未成对的电子数最多可达 ( )
A.4个 B.5个 C.6个 D.7个
难度: 中等查看答案及解析
-
若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是( )
A. 该元素基态原子中共有3个电子 B. 该元素原子核外有5个电子层
C. 该元素原子最外层共有8个电子 D. 该元素原子M电子层共有8个电子
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3﹣、dD﹣具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C3﹣>D﹣>B+>A2+ D.元素的第一电离能:A>B>D>C
难度: 中等查看答案及解析
-
不能说明X的电负性比Y的大的是( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
难度: 简单查看答案及解析
-
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
A.由极性键构成的极性分子 B.由非极性键构成的非极性分子
C.由非极性键构成的极性分子 D.由极性键构成的非极性分子
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.NH3、CO、CO2 都是极性分子
B.CH4、CCl4 都是含有极性键的非极性分子
C.HF、HCl、HBr、HI 的稳定性依次增强
D.CS2、H2O、C2H2 都是直线形分子
难度: 中等查看答案及解析
-
根据实际和经验推知,下列叙述不正确的是( )
A.卤化氢易溶于水,不易溶于四氯化碳
B.碘易溶于汽油,微溶于水
C.氯化钠易溶于水,也易溶于食用油
D.丁烷易溶于煤油,难溶于水
难度: 简单查看答案及解析
-
下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的还原性依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
难度: 简单查看答案及解析
-
下列分子中所有原子的价电子层都满足最外层8电子结构的是
A.六氟化氙(XeF6) B.次氯酸(HClO)
C.二氯化硫(SCl2) D.三氟化硼(BF3)
难度: 中等查看答案及解析
-
下列有关离子晶体的叙述不正确的是
A.1 mol氯化钠中有NA个NaCl分子
B.氯化钠晶体中,每个Na+周围距离最近且相等的Cl-共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.平均每个NaCl晶胞中有4个Na+、4个Cl-
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.任何晶体中,若含有阳离子也一定含有阴离子
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键不含有共价键
D.分子晶体中只存在分子作用力,不含有其他化学键
难度: 简单查看答案及解析
-
下列分子的中心原子形成sp2杂化轨道的是 ( )
A.H2O B.NH3 C.C2H4 D.CH4
难度: 简单查看答案及解析
-
已知CsCl晶体的密度为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的摩尔质量可以表示为(单位:g/mol)
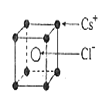
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在NaCl晶体中与每个Na+距离等同且最近的几个Cl-所围成的空间几何构型为
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
难度: 简单查看答案及解析
-
下列各物质的晶体中,晶体类型相同的是
A.O2和SiO2 B.NaI和I2 C.CO2和H2O D.CCl4和NaCl
难度: 简单查看答案及解析
-
下列物质中,既含极性键又含配位键的离子晶体是
A.Ba(OH)2 B.H2SO4 C.(NH4)2SO4 D.CaF2
难度: 简单查看答案及解析
-
同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是 ( )
A.在加热时此化合物可以分解
B.它是一种离子化合物
C.这种化合物不能跟强碱发生化学反应
D.该化合物在一定条件下由PH3与HI化合而成
难度: 中等查看答案及解析
-
X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲。X、Y、Z 3种元素形成化合物乙。下列说法不正确的是
A.原子半径:W>Y>Z>M>X
B.化合物乙中一定只有共价键
C.W元素是一种亲氧元素
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
难度: 中等查看答案及解析
-
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,下列说法正确的是( )
X
Y
Z
W
A. 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C. 若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D. 若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
难度: 困难查看答案及解析