-
下列现象或说法与盐类水解无关的是( )
A. 浓的硫化钠溶液有臭味 B. 加热稀醋酸溶液其pH稍有减小
C. 纯碱溶液去油污 D. 泡沫灭火器的使用原理
难度: 中等查看答案及解析
-
25℃时,已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现向等浓度NaCl和NaBr的混合溶液中逐滴加入稀AgNO3溶液,先沉淀的是
A. AgCl B. AgBr C. 同时沉淀 D. 无法判断
难度: 简单查看答案及解析
-
0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当—个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积是
A.5.6L B.6.72L
C.1.344L D.11.2L
难度: 中等查看答案及解析
-
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,而黑色沉淀为CuS
B.利用该原理可实现一种沉淀转化为更难溶的沉淀
C.该过程破坏了ZnS的溶解平衡
D.上述现象说明ZnS的Ksp小于CuS的Ksp
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是
A.NaHCO3 ═ Na++H++CO32- B.NaHSO4 ═ Na++H++SO42-
C.Al2(SO4)3 ═ Al3++SO42- D.NH3•H2O ═ NH4++OH-
难度: 简单查看答案及解析
-
下列原子或原子团不属于官能团的是( )
A.—CH3 B.—F C.—OH D.
难度: 简单查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vc=2vB,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
难度: 简单查看答案及解析
-
在可逆反应中,改变下列条件,一定能加快反应速率的是
A.增大反应物的量 B.升高温度 C.增大压强 D.增大容器体积
难度: 简单查看答案及解析
-
25℃,在0.01mol/LH2SO4溶液中,由水电离出的c(H+)是
A.1×10-12mol/L B.0.02mol/L C.1×10-7mol/L D.5×10-13mol/L
难度: 中等查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
难度: 简单查看答案及解析
-
用已知浓度盐酸滴定未知浓度的NaOH溶液会导致测得NaOH溶液浓度偏高的是 ( )
A.滴定前滴定管中有气泡,滴定后消失
B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时俯视读数
D.锥形瓶取用NaOH待测液前加少量水洗涤
难度: 简单查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.2 mol/(L·min)
B.B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH-
B.钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+
D.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(s) - 2e-+2H2O(l)═PbO2(s)+4H+(aq)+SO42-(aq)
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:
,下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
难度: 中等查看答案及解析
-
结合下图判断,下列叙述正确的是
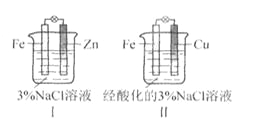
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液(此溶液遇Fe2+产生蓝色沉淀),均有蓝色沉淀
难度: 中等查看答案及解析
-
在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)
2C(g)。 经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A.用B表示反应速率为0.3 mol·L-1·s-1
B.平衡后,向容器中充入无关气体(如Ne),反应速率增大
C.3s时生成C的物质的量为1.2mol
D.平衡后,v(正) (A)=v(逆) (A)
难度: 中等查看答案及解析
-
下列实验不正确的是
序号
实验内容
实验目的
A
向5mL0.1mol/LK2Cr2O7溶液中滴加5滴浓硫酸
探究反应物浓度增大对化学平衡的影响
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶 液
说明一种沉淀能转化为另 一种溶解度更小的沉淀
C
室温下,用pH计测定浓度为0.1mol·L−1NaClO溶液和0.1mol·L−1CH3COONa溶液的pH
比较 HClO 和 CH3COOH 的 酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
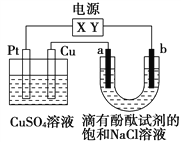
A.X极是电源负极,Y极是电源正极
B.电解过程中CuSO4溶液的pH逐渐增大
C.a极的电极反应是2Cl--2e-=Cl2↑
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
难度: 中等查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是

A.T1>T2,p1>p2,m+n>r,正反应吸热
B.T1<T2,p1<p2,m+n<r,正反应吸热
C.T1>T2,p1>p2,m+n<r,正反应放热
D.T1<T2,p1<p2,m+n>r,正反应放热
难度: 中等查看答案及解析
-
某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是
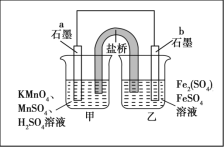
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
难度: 中等查看答案及解析
-
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )

A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
难度: 中等查看答案及解析
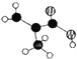 (图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。