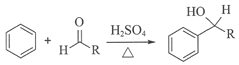
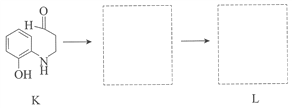
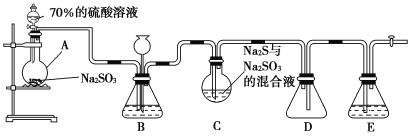
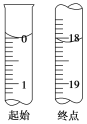
-
室温时,下列各溶液的叙述中正确的是
A. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B. 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-) ]
C. 0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b
D. 0.10mol·L-1CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
难度: 中等查看答案及解析
-
下列与化学有关的文献,理解错误的是
A. 《咏石灰》(明·于谦)中“…烈火焚烧若等闲…要留清白在人间”其中“清白”是指氢氧化钙
B. 《咏煤炭》(明·于谦)中“凿开混沌得乌金…不辞辛苦出山林”其中“乌金”的主要成分是煤炭
C. 《天工开物》中记载:“以消石、硫磺为主。草木灰为辅。…魂散惊而魄齑粉”文中提到的是火药
D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“裘”主要成分是蛋白质
难度: 简单查看答案及解析
-
化学与材料、生活和环境密切相关。下列有关说法中正确的是( )
A. 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料
B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C. “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
D. 新型材料聚酯纤维、光导纤维都属于有机高分子化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,1 mol浓硝酸与足量Al反应,转移电子数为3NA
B.标准状况下,5.6 L Cl2完全溶解于水配成1 L溶液,溶液中Cl-数为0.5NA
C.20 gH218O含有的中子数为10NA
D.1 L 0.5 mol·L-1 Al2(SO4)3溶液中阳离子所带电荷数为3NA
难度: 中等查看答案及解析
-
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
难度: 中等查看答案及解析
-
白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中不正确的是
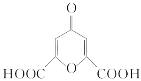
A.分子式是C7H4O6 B.能发生加成反应
C.能发生水解反应 D.能发生酯化反应
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
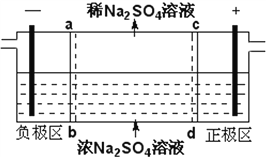
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析