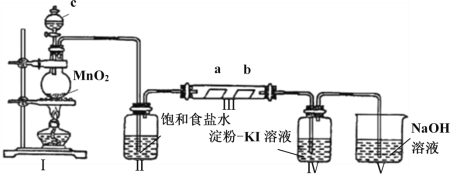
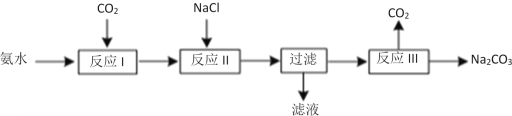
-
下列物质与常用危险化学品的类别不对应的是
A. 氯气——易燃气体 B. 汽油——易燃液体
C. 硫酸——腐蚀品 D. 高锰酸钾——氧化剂
-
下列关于Fe(OH)3胶体和MgCl2溶液性质叙述正确的是
A. 均能够产生丁达尔效应 B. 微粒直径均在1~100 nm之间
C. 分散质微粒均可透过滤纸 D. 加入少量NaOH 溶液,只有MgCl2溶液产生沉淀
-
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离水和乙醇 | 分液 | 水和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去丁醇(沸点117.5℃) 中的乙醚(沸点34.6℃) | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
A. A B. B C. C D. D
-
下列离子的检验方法正确的是( )
A.向某溶液中加入硝酸银溶液产生白色沉淀,说明原溶液中有Cl-
B.向某溶液中加入氯化钡溶液产生白色沉淀,说明原溶液中有SO42-
C.向某溶液中加入氢氧化钠溶液产生蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加入稀硫酸生成无色气体,说明原溶液中有CO32-
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1mol KClO3参加反应有2 mol电子转移
-
下列物质中,不属于合金的是( )
A.硬铝 B.黄铜 C.水银 D.钢铁
-
下列物质中属于电解质且能导电的是( )
A.乙醇 B.铜 C.熔融氯化钾 D.氨水
-
下列实验操作错误的是
A.实验中剩余的钠不能再放回原试剂瓶
B.分液漏斗使用前需要先检查是否漏液
C.做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D.蒸馏烧瓶加热时需要垫石棉网
-
配制500mL0.1mol/L的NaCl溶液,下列说法或操作正确的是( )
A.将NaCl固体直接放在托盘天平的托盘上称量
B.用托盘天平准确称量干燥的NaCl固体2.925g
C.在500mL容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线
D.准确称量2.9g混有KCl的NaCl固体,其他操作均正确,配好后的溶液中c(Cl-)偏低
-
浓硫酸具有很多重要的性质,在于含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.吸水性 C.脱水性 D.强氧化性
-
下列各组离子,因发生氧化还原反应而不能大量共存的是
A.K+、Fe3+、SCN–、Cl– B.Fe3+、K+、OH–、SO42–
C.Fe2+、K+、Cl–、MnO4– D.Na+、H+、SO42–、CO32–
-
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.1mol甲烷的质量与甲烷的摩尔质量相等
D.16g水中所含的电子数为10NA
-
下列离子方程式书写正确的是( )
A.硅和氢氧化钠溶液反应:Si+2Na++2OH–+H2O=Na2SiO3 + 2H2↑
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.FeCl3溶液与Fe反应:2Fe3++Fe=3Fe2+
D.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
-
下列说法正确的是( )
A.25℃、1.01×105Pa时,同体积的H2和O2含有相同数目的原子数
B.1mol气态物质,当体积为22.4L时,该气体一定处于标准状况
C.2mol任何气体体积都约为44.8L
D.同温同压下,等质量的O2和O3两种气体的分子个数之比为1﹕1
-
向200mL0.1mo/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再充分灼烧后得到固体的质量为( )
A.1.44g B.1.6g C.1.8g D.2.14g
-
在200mL5mol/L稀硝酸中加入19.2g铜粉,待充分反应,判断下列说法正确的是(忽略反应前后溶液体积的变化)( )
A.反应中转移电子的物质的量为0.6NA
B.标准状况下,产生NO2气体的体积为4.48L
C.反应后,H+的物质的量浓度为1.0mol/L
D.被还原的HNO3的物质的量为0.6mol
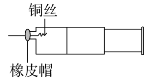
5N2+6H2O,每有10molN2生成,氧化产物与还原产物的物质的量之比为__。