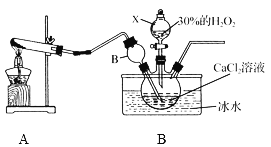
-
下列有关物质的性质与用途具有对应关系的是
A. MgO具有高熔点,可用于制耐火材料
B. NaHCO3受热易分解,可用于治疗胃酸过多
C. 金属铜具有金属光泽,可用作导电材料
D. 浓硫酸具有脱水性,可用作干燥剂
难度: 中等查看答案及解析
-
南京大屠杀死难者国家公祭鼎。关于铜的一种微粒6429Cu2+,下列说法正确的是
A. 核外电子数为29 B. 质子数为27
C. 核电荷数为27 D. 中子数为35
难度: 简单查看答案及解析
-
将少量氯水加入KI溶液中振荡,再加入CCl4,振荡,静置后观察到的现象是
A. 形成均匀的紫色溶液 B. 有紫色沉淀析出
C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色
难度: 中等查看答案及解析
-
紫水晶被誉为“爱的守护石”,寓意“忠诚、勇敢”,其主要成分可表示为
A.Si B.SiO2
C.H2SiO3 D.Na2SiO3
难度: 简单查看答案及解析
-
“g·mol-1”是下列哪个物理量的单位
A.物质的质量 B.物质的量
C.摩尔质量 D.微粒个数
难度: 简单查看答案及解析
-
下列属于碱性氧化物的是( )
A.Na2CO3 B.NaOH C.CaO D.CO2
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.过氧化钠的化学式: Na2O2
B.Mg2+的结构示意图:
C.以氧化物的形式表示镁橄榄石(Mg2SiO4)的组成:MgO·SiO2
D.氯化镁的电离方程式: MgCl2 = Mg2+ + Cl2-
难度: 中等查看答案及解析
-
下列物质属于电解质的是
A.铜 B.氯化钠
C.稀硫酸 D.乙醇
难度: 中等查看答案及解析
-
下列过程涉及化学变化的是
A.碘的升华 B.滴水成冰
C.花香四溢 D.高炉炼铁
难度: 中等查看答案及解析
-
下列物质主要成份或名称与化学式对应的是
A.苏打——NaHCO3 B.胆矾 —— CuSO4
C.赤铁矿—— Fe2O3 D.漂白粉——Ca(ClO)2
难度: 简单查看答案及解析
-
在含有大量H+、Ca2+、Cl-的溶液中,还可能大量共存的离子是
A.OH- B.CO32- C.Ag+ D.Mg2+
难度: 中等查看答案及解析
-
ClO2 是一种高效杀菌剂。工业上可通过以下反应制得 ClO2:2NaClO3+Na2SO3+H2SO4= 2ClO2↑+2Na2SO4 + H2O。下列说法正确的是
A.NaClO3 是氧化剂
B.每消耗1mol Na2SO3 则产生44.8L ClO2
C.NaClO3 发生氧化反应
D.Na2SO4是还原产物
难度: 中等查看答案及解析
-
现代化工制造硝酸的方法主要是氨催化氧化法。该步反应的化学方程式为:4NH3+5O2
4NO+6H2O,对该反应类型的判断正确的是
A.是置换反应
B.是分解反应
C.是复分解反应
D.不属于四种基本反应
难度: 中等查看答案及解析
-
实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
难度: 中等查看答案及解析
-
下列实验正确的是( )
A.
 定容 B.
定容 B.  制氨气
制氨气C.
 制蒸馏水 D.
制蒸馏水 D.  检验钾离子
检验钾离子难度: 中等查看答案及解析
-
下列反应可以用同一离子方程式表示的是 ( )
A. HCl溶液+Na2CO3溶液;HCl溶液+NaHCO3溶液
B. NaOH溶液+HCl溶液;Ba(OH)2溶液+H2SO4溶液
C. BaCl2溶液+H2SO4溶液;Ba(OH)2溶液+Na2SO4溶液
D. CaCO3+HCl溶液;Na2CO3溶液+H2SO4溶液
难度: 简单查看答案及解析
-
检验 SO2 气体中是否混有 CO2 气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过足量酸性 KMnO4 溶液,再通过澄清石灰水
D.先通过 NaOH 溶液,再通过澄清石灰水
难度: 中等查看答案及解析
-
下列知识梳理总结不合理的是( )
A.卢瑟福发现原子中存在原子核,提出了“带核”的原子结构模型
B.用一束光照射氢氧化铁胶体,可观察到丁达尔现象
C.地球上 99%以上的溴元素存在海洋中,所以溴被称为“海洋元素”
D.蔗糖中加入浓硫酸,变成“黑面包”,只体现了浓硫酸的脱水性
难度: 简单查看答案及解析
-
下列有关浓硝酸的说法不正确的是
A.沸点较高,不易挥发
B.为防止见光分解,保存在棕色瓶中
C.受热易分解,分解产生的气体又溶解在浓硝酸中,会使浓硝酸显黄色
D.常温下就能与铜反应,生成红棕色气体
难度: 中等查看答案及解析
-
下列分离或提纯物质的方法正确的是
A.用酒精萃取溴水中的溴单质
B.用蒸馏的方法分离汽油和水的混合物
C.用加水溶解、过滤、洗涤、烘干的方法除去 MnO2 固体中的 KCl
D.用过滤的方法除去 NaCl 溶液中含有的少量碘单质
难度: 中等查看答案及解析
-
下列有关硫及其化合物的说法中正确的是
A.浓硫酸具有吸水性,可做干燥剂,如可干燥氯气、二氧化硫、氨气等
B.浓硫酸与炭共热反应,仅体现了浓硫酸的强氧化性
C.SO2 和 Cl2 均可使品红溶液褪色,但溶有 SO2 的品红溶液加热后恢复红色,说明 SO2 的氧化性没有 Cl2强
D.以 FeS2 为原料生产硫酸过程中,要用到沸腾炉、接触室、吸收塔等设备,所涉及的反应均为氧化还原反应
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
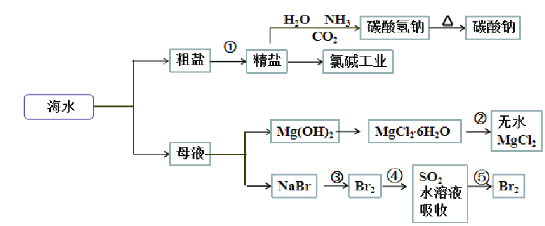
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
下列有关说法正确的是
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上将石灰水加入到海水中得到Mg(OH)2沉淀
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.钠与水反应:Na + H2O = Na+ + OH- + H2↑
B.铜与氯化铁溶液反应:2Fe3+ + 3Cu =2Fe + 3Cu2+
C.碳酸钙与醋酸反应:CO32-+ 2CH3COOH = 2CH3COO-+CO2↑ + H2O
D.铜与稀硝酸反应:3Cu + 8H+ + 2NO3-= 3Cu2+ + 2NO↑ + 4H2O
难度: 中等查看答案及解析
-
对于某些常见离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42-
C.加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
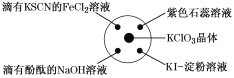
选项
实验现象
结论
A
滴有KSCN的FeCl2溶液变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液褪色
Cl2具有酸性
C
紫色石蕊溶液先变红后褪色
Cl2具有漂白性
D
KI淀粉溶液变成蓝色
Cl2具有氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )

A.沉淀A中含有2种金属单质
B.可用 KSCN 溶液来检验溶液B中所含的金属离子
C.溶液 A 若只经过操作③最终将无法得到沉淀C
D.操作①②③中都需要用到玻璃棒、漏斗
难度: 中等查看答案及解析