-
下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
难度: 中等查看答案及解析
-
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
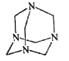
A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
难度: 困难查看答案及解析
-
氰化物有剧毒,在碱性条件下可用如下方法进行处理:
。下列判断错误的是
A.上述反应中的氧化剂是
B.还原性:
>
C.当有0.2mol
生成时,溶液中阴离子的物质的量增加1mol
D.经测定
的水溶液呈碱性,说明
促进了水的电离
难度: 简单查看答案及解析
-
使用化学手段可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是( )
A.在燃煤中添加生石灰
B.将某些废旧塑料熔化后再成型
C.把放射性核废料深埋于地下岩层
D.用多孔吸附剂清除水面油污
难度: 简单查看答案及解析
-
中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法。下列说法中正确的是
A. 正是氢键的存在,冰能浮在水面上
B. 氢键是自然界中最重要、存在最广泛的化学键之一
C. 由于氢键的存在,沸点:HCl>HBr>HI>HF
D. 由于氢键的存在,水分子中氢氧键角是104.50°
难度: 中等查看答案及解析
-
化学与生活息息相关。下列说法错误的是
A.喝下汽水后常会打嗝,说明气体的溶解度随温度升高而减小
B.自行车钢架生锈主要是电化学腐蚀所致
C.可以通过灼烧的方法鉴别锦纶和蚕丝
D.凡是有食品添加剂的食物对人体健康均有害,不可食用
难度: 中等查看答案及解析
-
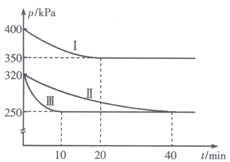
经一定时间后,可逆反应aA+bB
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是

A.该反应在T1、T3温度时达到化学平衡
B.该反应在T1温度时达到化学平衡
C.该反应为放热反应
D.升高温度,平衡会向正反应方向移动
难度: 简单查看答案及解析
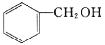 C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH