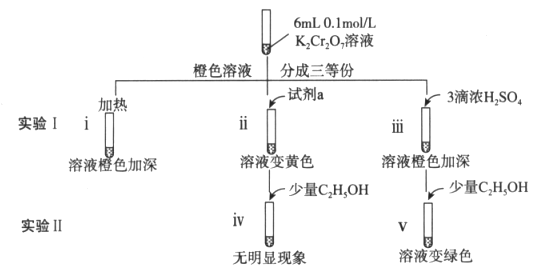
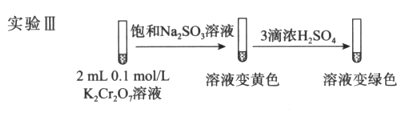
-
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2②NO2和O2③NH3和
现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为
、
、
,则下列关系正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.已知
,则
的燃烧热为
B.已知甲烷氧化:
,则反应物的键能总和大于生成物的键能总和
C.已知
,则将
和
置于一密闭容器中充分反应后放出
的热量
D.含
的稀溶液与稀盐酸完全中和,放出
的热量,则该反应的热化学方程式为:
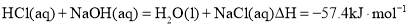
难度: 中等查看答案及解析
-
常温下,向100 mL 0.01 mol•L﹣1 HA溶液中逐滴加入0.02 mol•L﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
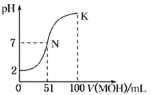
A.HA为一元强酸,MOH为一元弱碱
B.N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C.N点水的电离程度大于K点水的电离程度
D.N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
难度: 中等查看答案及解析
-
反应N2O4(g)⇌NO2(g)△H=+57kJ•mol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )
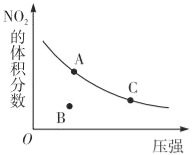
A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
难度: 中等查看答案及解析
-
下列关于物质分类的正确组合是
分类
组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
纯碱
H2SO4
NaHCO3
SiO2
CO2
B
NaOH
HCl
NaCl
Na2O
CO
C
烧碱
CH3COOH
CaF2
Na2O2
SO2
D
KOH
HNO3
CaCO3
CaO
SO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
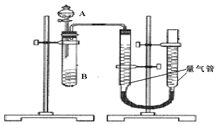
通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
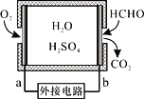
A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
难度: 中等查看答案及解析
-
下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()
A.
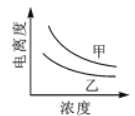 B.
B. C.
C.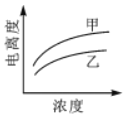 D.
D.
难度: 中等查看答案及解析
-
在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)⇌2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min
2
4
7
9
n(Y)∕mol
0.12
0.11
0.10
0.10
A.反应前4min的平均反应速率υ(Z)=0.0125mol•L-1•min-1
B.其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C.其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
D.该温度下此反应的平衡常数K=1.44
难度: 简单查看答案及解析
-
共价键、离子键和分子间作用力是粒子之间的三种作用力.下列晶体:①NaOH② SiO2 ③石墨④NaCl⑤干冰中,含有两种作用力的是( )
A.①②③ B.①③⑤ C.②④⑤ D.②③④
难度: 简单查看答案及解析
-
能证明
溶液中存在水解平衡SO32-+H2O⇌HSO3-+OH-的事实是
A.滴入酚酞溶液变红,再加入
溶液红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,在加入
溶液后产生沉淀且红色褪去
难度: 简单查看答案及解析
-
在一密闭容器中,反应
达到平衡时,测得
为
在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得
为
下列判断中不正确的是
A.物质B的质量分数减小 B.平衡时逆反应速率减小
C.化学计量数:
D.物质C的体积分数不变
难度: 中等查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
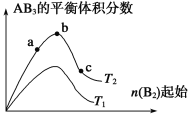
A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
难度: 困难查看答案及解析
-
下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中
A.①②③ B.②④⑤ C.①④⑤ D.①②④
难度: 简单查看答案及解析
-
表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式
CH3COOH
HClO
H2CO3
Ka
1.8×10﹣5
3.0×10﹣8
Ka1=4.1×10﹣7 Ka2=5.6×10﹣11
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C.少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D.等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
难度: 中等查看答案及解析