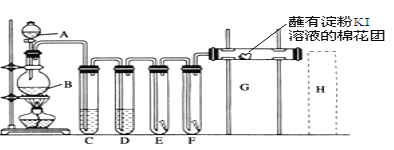
-
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2===2Ag2S+2H2O,其中H2S是
A. 氧化剂 B. 还原剂 C. 既是氧化剂又是还原剂 D. 既不是氧化剂又不是还原剂
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.除去NaCl固体中的少量KNO3,将固体溶解后蒸发结晶,趁热过滤,洗涤,干燥
B.FeCl3可用于腐蚀Cu刻制印刷电路板,这说明铁的金属性比铜强
C.配制质量分数为20 %的NaOH溶液时,需要用到的玻璃仪器为容量瓶、烧杯、玻璃棒
D.工业上用氯气和石灰水反应制漂白粉,保存漂白粉的塑料袋要密封
难度: 中等查看答案及解析
-
胶体区别于其它分散系的本质特征是
A.胶体的分散质能透过滤纸
B.胶体能产生丁达尔现象
C.胶体的分散质粒子直径在1~100mm之间
D.胶体是纯净物,其它分散系是混合物
难度: 简单查看答案及解析
-
下列有关0.1 mol·L-1 NaOH溶液的叙述正确的是 ( )
A.1 L该溶液中含有NaOH 40 g B.100 mL该溶液中含有Na+ 0.01 mol
C.从1 L该溶液中取出100 mL,所取出的NaOH溶液的浓度为0.01 mol·L-1 D.在1 L水中溶解4 g NaOH即可配制得0.1 mol·L-1 NaOH溶液
难度: 简单查看答案及解析
-
下列关于实验操作的叙述不正确的是
A.蒸馏时,在烧瓶中加几粒沸石
B.加液时,胶头滴管悬置在试管正上方
C.萃取时,分液漏斗正立振荡后,直接放在铁架台上,静置
D.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
难度: 简单查看答案及解析
-
将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液;③Ca(ClO)2溶液;④饱和Na2CO3溶液;⑤NaAlO2 最终有沉淀析出的是
A.②④⑤ B.①②③④ C.②③④⑤ D.②③④
难度: 中等查看答案及解析
-
下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入稀硝酸无明显现象,再加盐酸溶液产生沉淀,一定有Ag+
C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
D.加入氯水,再加KSCN溶液显红色,一定有Fe3+
难度: 中等查看答案及解析
-
化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是
A.硅是良好的半导体材料,可以用作光导纤维
B.酸雨是指pH<7.0的雨水
C.居室中放置一盆石灰水可以吸收CO,预防中毒
D.水玻璃可以用作木材防火剂
难度: 中等查看答案及解析
-
实验室里需要配制480mL0.1mol/L的硫酸铜溶液,下列实验用品及实验操作都正确的是
选项
容量瓶的容积
固体质量
实验操作
A
480mL
硫酸铜:7.7g
加入500mL水
B
480mL
胆矾:12.0g
配成500mL溶液
C
500mL
硫酸铜:8.0g
加入500mL水
D
500mL
胆矾:12.5g
配成500mL溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
分类是重要的科学研究方法,下列物质分类正确的是
A.电解质:胆矾、一水合氨、硫酸钡、CaO B.酸性氧化物:CO2、SO2、NO2、SiO2
C.混合物:铝热剂、干冰、水玻璃、盐酸 D.弱酸:氢碘酸、醋酸、碳酸、次氯酸
难度: 简单查看答案及解析
-
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的( )
A.Na+ B.OH-
C.S2- D.Cl-
难度: 中等查看答案及解析
-
下列变化的实质相似的是
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液和溴水褪色
④溴化氢和碘化氢气体均不能用浓硫酸干燥
⑤浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
A.只有②③④ B.只有④ C.只有③④ D.全部
难度: 中等查看答案及解析
-
下列解释实验现象的反应方程式正确的是( )
A.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
B.金属钠比金属铜活泼,金属钠放入CuSO4溶液:CuSO4+2Na=Cu+Na2SO4
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2+2CO2=2Na2CO3+O2
D.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
难度: 中等查看答案及解析
-
下列物质:①水泥 ②玻璃 ③陶瓷 ④水晶,其中属于硅酸盐工业产品的是( )
A.只有①② B.只有②④ C.只有①②③ D.全部
难度: 简单查看答案及解析
-
下列各组物质稀溶液相互反应。无论前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.Na2CO3溶液与HCl溶液 B.AlCl3溶液与NaOH溶液
C.KAlO2 溶液与HCl溶液 D.Na2SiO3溶液和HCl溶液
难度: 中等查看答案及解析
-
下列物质不能通过化合反应直接制得的是
A.NaCl B.Al(OH)3 C.FeCl2 D.CO
难度: 简单查看答案及解析
-
化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
D.屠呦呦提取青蒿素加入乙醚萃取,此过程属于化学变化
难度: 中等查看答案及解析
-
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
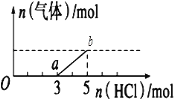
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5mol•L﹣1
难度: 困难查看答案及解析
-
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、CO32- B.Mg2+、Cl-、 NH4+、SO42-
C.K+、Cl-、HCO3-、NO3- D.Ca2+、Na、 Fe3+、 NO3-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A. 常温常压下,8gO2和O3的混合气体含有4NA个电子
B. 1L0.1mol/L的FeCl3完全水解,形成0.1NA个Fe(OH)3胶体粒子
C. 标准状况下,22.4LCl2通入水中发生反应,转移的电子数为NA
D. 1molNa被完全氧化生成Na2O2,失去个2NA电子
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知
类推
A
将Fe加入CuSO4溶液中:
Fe + Cu2+ = Cu + Fe2+
将Na加入到CuSO4溶液中:
2Na + Cu2+ = Cu + 2Na+
B
稀硫酸与Ba(OH)2溶液反应至溶液呈中性:
2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
NaHSO4溶液与Ba(OH)2溶液反应呈中性:
2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O
C
铁和氯气反应2Fe+3Cl2
2FeCl3
铁和单质反应2Fe+3I2
2FeI3
D
向Ca(ClO)2溶液中通入少量CO2:
Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:
Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol/L的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现。若用过量的CO在高温下还原原混合物,固体质量减少为
A.1.6g B.2.4g C.3.2g D.4.8g
难度: 中等查看答案及解析
-
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如下图所示。.则下列说法不正确的是:
A. 镁和铝的总质量为9 g
B. 最初20 mLNaOH溶液用于中和过量的硫酸
C. 硫酸的物质的量浓度为2.5 mol·L-1
D. 生成的氢气在标准状况下的体积为11.2 L
难度: 中等查看答案及解析