-
下列转化过程中必须加入还原剂的是
A. FeS→H2S B. SO2→SO32- C. Fe3+→Fe2+ D. Cu→Cu2+
难度: 简单查看答案及解析
-
华裔科学家高锟因“在光学通信领域中光在光导纤维中传输”的研究方面所取得的开创性成就获得了诺贝尔物理学奖。光导纤维的主要成分是( )
A. Si B. SiO2 C. Na2SiO3 D. SiCl4
难度: 简单查看答案及解析
-
把7.4 g由 Na2CO3•10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液, 其中c(Na+)=0.6 mol•L-1。若把等质量的混合物加热至恒重,残留物的质量是
A. 2.12g B. 3.18g C. 4.22g D. 5.28g
难度: 简单查看答案及解析
-
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,则下列氧化还原反应能发生的是
A.2Y-+W2=2W-+Y2 B.2X-+Y2=2Y-+X2
C.2W-+Z2=2Z-+W2 D.2Z-+X2=2X-+Z2
难度: 中等查看答案及解析
-
分类是学习和研究化学的一种重要方法,下列分类合理的是
A.烧碱和纯碱都属于碱 B.硫酸和盐酸都属于含氧酸
C.Na2SiO3和Na2SO4都属于钠盐 D.Fe2O3和Al2O3都属于碱性氧化物
难度: 中等查看答案及解析
-
进入秋冬季节后,雾霾这种环境污染问题逐渐凸显。从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是: ( )
A.胶粒可以导电 B.胶体粒子大小在1~100nm之间
C.胶体是混合物 D.胶体的分散剂为气体
难度: 简单查看答案及解析
-
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,可用适当方法在包装袋中装入
A.无水硫酸铜、蔗糖 B.生石灰、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
难度: 中等查看答案及解析
-
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A.Cu2+ B.AlO2- C.Al3+ D.Mg2+
难度: 简单查看答案及解析
-
下列各组中两种物质反应时,反应条件或反应物用量改变,对生成物没有影响的是( )
A.Na与O2 B.Na2O2与CO2
C.Na2CO3溶液与盐酸 D.NaAlO2溶液与盐酸
难度: 中等查看答案及解析
-
从氧化还原角度分析,下列反应中水的作用相同的是
① 铁和水蒸气反应 ② 过氧化钠和水反应
③氯气和水反应 ④ 二氧化氮和水反应3NO2+H2O=2HNO3+NO
A.①②③ B.①②④ C.②③④ D.①③④
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。下列说法正确的是
A.该溶液中最多存在4种离子
B.该溶液中不能确定是否存在CO32-
C.该溶液中一定存在Cl-、且c(Cl-)≥0.4mol∙L-1
D.该溶液可由KCl、(NH4)2SO4和FeCl3配制而成
难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与50mL1mol·L-1MgCl2溶液中的Cl浓度相等的是( )
A.25mL1mol·L-1Ca(ClO)2溶液 B.100mL2mol·L-1KCl溶液
C.25mL1mol·L-1AlCl3溶液 D.100mL1mol·L-1NaCl溶液
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是( )
选项
现象或事实
解释
A
常用铝箔做包装材料
金属铝有好的延展性
B
FeCl3溶液可用于刻制印刷铜电路板
FeCl3可与Cu发生反应
C
烧菜用过的铁锅,经放置常出现红棕色斑迹
烧菜时铁锅被染色
D
Na2O2常用于潜水艇或呼吸面具的供氧剂
Na2O2与H2O、CO2反应产生O2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.钠和水反应:Na+2H2O=Na++2OH-+H2↑
B.向烧碱溶液中通入过量的CO2:CO2+2OH-=CO32-+H2O
C.氢氧化铝和氢氧化钠溶液反应:Al(OH)3+OH-=AlO2-+2H2O
D.Cl2溶于水:Cl2+H2O=2H++Cl-+ClO-
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在强碱性溶液中:K+、Na+、CO32-、AlO2-
B.与铝反应产生氢气的溶液中:Na+、K+、HCO3-、Cl-
C.FeCl3溶液中:K+、Na+、SO42-、SCN-
D.在盐酸溶液中:K+、Fe2+、SO32-、MnO4-
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是( )
A.把H2SO4放入水中:H2SO4=H2++SO42-
B.把Ba(OH)2放入水中:Ba(OH)2=Ba2++(OH)2-
C.把NaHSO4放入水中:NaHSO4=Na++H++SO42-
D.把CaCl2放入水中:CaCl2=Ca2++Cl2-
难度: 简单查看答案及解析
-
下列物质间的每步转化只需通过一步反应就能实现的是( )
A.Na→Na2O2→Na2CO3→NaOH B.Si→SiO2→H2SiO3→Na2SiO3
C.Al→Al(OH)3→Al2O3→NaAlO2 D.Fe→Fe2O3→Fe(OH)3→FeCl3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1molAl和足量NaOH溶液反应生成的H2体积一定为33.6L
B.3mol单质Fe完全转变为Fe3O4,失去8NA个电子
C.23gNa与足量H2O反应完全后可生成NA个H2分子
D.标准状况下,22.4LN2和H2混合气中含NA个原子
难度: 中等查看答案及解析
-
使0.15molMnO2与过量的12mol·L-1的浓盐酸反应,使50mL12mol·L-1的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)( )。
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
难度: 中等查看答案及解析
-
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是( )
A.每生成0.1molClO2转移0.2mol电子
B.氧化性:NaClO3<Cl2
C.浓盐酸在反应中仅体现还原性
D.被氧化和被还原的氯物质的量之比为1:1
难度: 中等查看答案及解析
-
在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生。则下列结论正确的是( )
A.滤液中一定有Fe(NO3)3 B.滤渣只含Ag和Cu,一定无Zn
C.滤渣中一定有Ag、Cu和Fe,一定无Zn D.滤渣中一定有Ag、Cu、Fe和Zn
难度: 中等查看答案及解析
-
V L Al2(SO4)3溶液中含Al3+a g,将此溶液稀释到4V L,则稀释后溶
的物质的量浓度是( )
A.
mol·L−1 B.
mol·L−1 C.
mol·L−1 D.
mol·L−1
难度: 中等查看答案及解析
-
下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
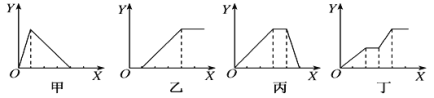
A.丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
B.丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
C.乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D.甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
难度: 困难查看答案及解析
-
有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
难度: 简单查看答案及解析