-
化学与人类生活、生产和社会可持续发展密切相关,下列有关说法正确的是
A. 中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
B. 中国华为自主研发的5G芯片巴龙5000的主要材料是Si
C. 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D. 用铜片制成的“纳米铜”具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是
A. H2O2的电子式:
B. 核内含8个中子的碳原子:8C
C. 丙烷分子的比例模型示意图:
D. 铝硅酸盐Na2Al2Si2O8可用氧化物形式表示为:Na2O·Al2O3·2SiO2
难度: 简单查看答案及解析
-
下列说法正确的是
A.煤的干馏和石油的分馏都是化学变化
B.漂白粉、水玻璃和碱石灰都是混合物
C.纯碱、明矾和干冰都是电解质
D.乙酸乙酯中混有乙酸,可加入饱和氢氧化钠溶液,振荡、静置后分液
难度: 中等查看答案及解析
-
下列有关有机物结构和性质的说法错误的是( )
A.分子式为C4H10O且能与 Na反应放出气体的结构共有4种
B.石油是混合物,可通过分馏得到汽油、煤油等纯净物
C.苯甲酸(
)分子中所有原子可能位于同一平面
D.1mol盐酸美西律(
)最多可与3 mol H2发生加成
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.Fe(NO3)3加入过量的HI溶液:2Fe3++2I−=2Fe2++I2
B.向NH4HSO3溶液中加少量的NaOH溶液:NH4++OH−=NH3·H2O
C.将1mol Cl2通入到含1mol FeI2的溶液:2Fe2++2I−+2Cl2=2Fe3++I2+4Cl-
D.0.01 mol·L−1 NH4Al(SO4)2溶液与0.02 mol·L−1 Ba(OH)2溶液等体积混合:NH4++Al3++2Ba2++4OH−+2SO42-=2BaSO4↓+Al(OH)3↓+NH3·H2O
难度: 中等查看答案及解析
-
在一个氧化还原反应体系中存在Fe3+、NO3-、Fe2+、NH4+、H+、H2O,则下列判断正确的是( )
A.配制Fe(NO3)2溶液时应加入硝酸酸化防止Fe2+水解
B.该反应中氧化剂与还原剂的化学计量数之比为8 :1
C.若有1mol NO3-发生还原反应,转移的电子物质的量为1mol
D.若将该反应设计成原电池,则负极反应式为Fe2+-e-=Fe3+
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
①常温下pH=1的溶液中:Fe3+、SO42-、K+、MnO4-
②0.1mol/LNa2S溶液:K+、NH4+、NO3-、Al3+
③中性透明溶液中:K+、SO42-、NO3-、Fe3+
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥25℃时,KW/[H+]=0.1 mol·L-1的溶液:Na+、K+、SiO32-、[Al(OH)4]-
A.②③ B.①⑥ C.③④⑤ D.①⑤⑥
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,X与Z同族,Y与Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y的最高价氧化物对应的水化物是二元强酸
B.原子半径:X<Z<Y
C.气态氢化物的热稳定性:Y<Z
D.X与W可形成两种阴、阳离子的物质的量之比均为1:2的离子化合物
难度: 中等查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项
实验
现象
结论
A
将红热的炭放入浓硫酸中产生的气体通入澄清的石灰水
石灰水变浑浊
炭被氧化成CO2
B
将稀盐酸滴入Na2SiO3 溶液中
溶液中出现凝胶
非金属性: Cl>Si
C
SO2通入BaCl2溶液,然后滴入稀硝酸
有白色沉淀产生,加入稀硝酸后沉淀不溶解
先产生BaSO3沉淀,后转化为BaSO4
D
向某溶液中滴加KSCN 溶液,溶液不变色,再滴加新制氯水
溶液显红色
原溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的有
①0.1mol丙烯酸中含有双键的数目为0.1NA
②12g金刚石中,碳碳共价键数为4NA
③常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2g
中含有的质子数、中子数、电子数均为NA
⑤常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
⑥10mL 18mol/L的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ①⑥ B. ④⑤⑥ C. ③④⑤ D. ①②⑥
难度: 简单查看答案及解析
-
中美贸易战中,稀土是我国一张重要的牌。稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3价和+4价:②氧化性:Ce4+>Fe3+。下列说法不正确的是
A. 工业上金属铈一般应低温密封保存
B. 工业上可以采取用H2还原氧化铈的方法来治炼金属铈
C. 工业上不可以采取电解氯化铈水溶液的方法来获得铈单质
D. 铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑
难度: 中等查看答案及解析
-
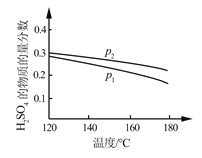
根据下列图示所得出的结论不正确的是
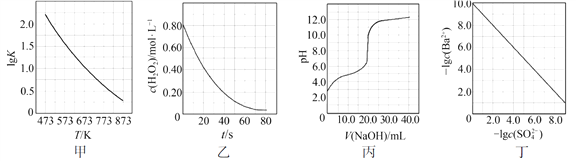
A.图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
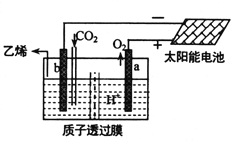
手持技术的氧电化学传感器可用于测定 O2含量,右图为某种氧电化学传感器的 原理示意图。已知在测定O2含量过程 中,电解质溶液的质量保持不变。一定时 间内,若通过传感器的待测气体为aL(标 准状况),某电极增重了b g。下列说法正确的是
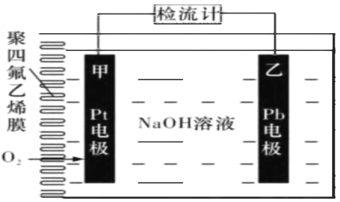
A.Pt电极为负极
B.反应过程中转移OH-的物质的量为0.125bmol
C.Pb电极上发生的电极反应为Pb-2e- +2OH- = Pb(OH)2
D.待测气体屮氧气的体积分数为
难度: 中等查看答案及解析
-
测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
A. Na₂SO3溶液中存在水解平衡:SO32-+H2O
HSO-3+OH-
B. ④的pH与①不同,是由于SO32-浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
难度: 困难查看答案及解析
-
已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是
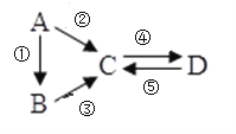
A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为△H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质,实验室保存D溶液的方法是加入适量铁粉与适量盐酸
难度: 困难查看答案及解析
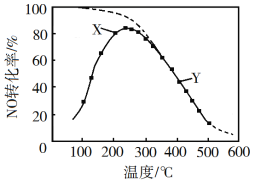
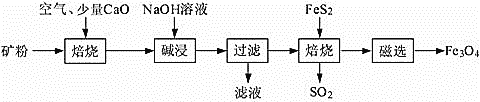
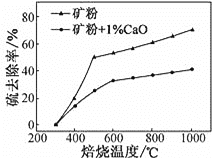
 )×100%
)×100%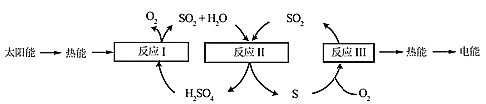
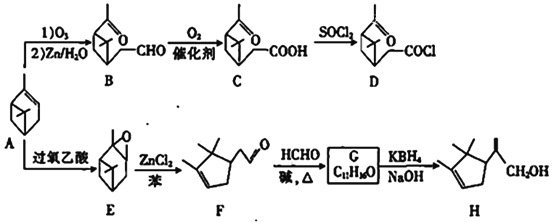
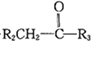
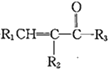 (R1、R2、R3为H或烃基)
(R1、R2、R3为H或烃基)