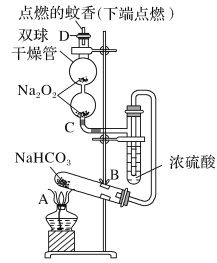
-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。这种做法的化学原因是
A. 胶体的电泳 B. 胶体的丁达尔效应
C. 胶体的布朗运动 D. 胶体的聚沉
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.稀硫酸滴加在铜片上:Cu +2H+=Cu2++H2↑
B.氧化铁粉末溶于稀盐酸:Fe2O3+ 6H+=2Fe3+ + 3H2O
C.硫酸滴加到氢氧化钡溶液中:H++ OH-=H2O
D.碳酸氢钠和盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④Al(OH)3 ⑤Na2SO4
A.①②③④⑤ B.②③④ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
某溶液中含有大量Fe2+、Al3+、Fe3+、Na+、Cl-、SO42-离子,其中加入足量Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是
A.Na+、Fe2+ B.Al3+、SO42- C.Fe3+、SO42- D.Al3+、Cl-
难度: 中等查看答案及解析
-
向下列各溶液中通入足量CO2气体,最终有浑浊现象产生的是( )
①饱和Na2CO3溶液 ②澄清石灰水 ③NaAlO2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液
A.①③⑤ B.③④⑤ C.①②④⑤ D.②③④⑤
难度: 中等查看答案及解析
-
下列实验操作中错误的是 ( )
A.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
B.蒸发操作时,应待混合物中有大量固体析出时停止加热,利用余热蒸干
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
某无色透明的酸性溶液中能大量共存的是( )
A.Na+、K+、Cu2+、SO42- B.NH4+、Na+、NO3-、Cl-
C.K+、Ca2+、HCO3-、Cl- D.Mg2+、Fe3+、Cl-、OH-
难度: 简单查看答案及解析
-
下列变化中,需加入适当的还原剂才能完成的是
A.KI→I
B.FeCl
→FeCl
C.CuO→Cu D.CO
→Na
CO
难度: 中等查看答案及解析
-
在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,当有10 mol电子发生转移后,被氧化的氯原子与被还原的氯原子的物质的量之比是
A.1∶5 B.5∶1 C.6∶1 D.1∶6
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,将22.4LCl2通入水中发生反应,转移的电子数为NA
B.1molO2作氧化剂时转移电子数一定为4NA
C.23gNa与O2充分反应生成Na2O和Na2O2的混合物,消耗O2分子数在0.25NA和0.5NA之间
D.在Na2O2与CO2的反应中,固体质量每增重28g,转移电子数2NA
难度: 中等查看答案及解析
-
下列除杂方案错误的是( )
选项
被提纯的物质
杂质
除杂试剂
A
FeCl3(aq)
Fe2+
通Cl2
B
AlCl3(aq)
Cu2+
Al粉
C
NaHCO3(aq)
Na2CO3
CO2气体
D
FeCl3(aq)
Cu2+
Fe粉
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y。下列叙述正确的是
A.沉淀X的成分是SiO2
B.从组成看,其成分皆是碱性氧化物
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分只有Fe(OH)3和Mg(OH)2
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.1 mol的CH4质量为16g/mol B.3.01×1023个CO2分子的质量约为22g
C.H2O的摩尔质量为18g D.标准状况下,1 mol任何物质体积均为22.4L
难度: 简单查看答案及解析
-
下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
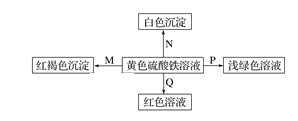
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
铜
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
锌粉
KSCN
D
Na2O2
MgCl2
Fe
KSCN
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
制印刷电路板的“腐蚀液”的应用原理:2FeCl3+Cu=2FeCl2+CuCl2。向盛有FeCl3溶液的烧杯中同时加入一定量的铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中铜、铁均有 B.烧杯中Fe3+、Cu2+、Fe2+均有
C.烧杯中Cu和Cu2+均有 D.烧杯中Cu2+、Fe2+、Cu和Fe均有
难度: 中等查看答案及解析
-
在配制0.1 mol/L NaOH溶液过程中,下列实验操作不正确的是
A.实验前要检验容量瓶是否漏水
B.配制溶液时,把称好的NaOH固体用纸条小心倒入容量瓶中,加水即可
C.转移溶液后要用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也要注入容量瓶
D.当加水至容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水至液面与刻度线相切
难度: 简单查看答案及解析
-
交通警察执法时常使用的便携式酒精检查仪可能应用了:3CH3CH2OH+2K2Cr2O7(橙色)+ 8H2SO4=3CH3COOH +2Cr2(SO4)3(蓝绿色)+2K2SO4+11H2O这一反应原理,关于该反应,下列说法正确的是( )
A.该反应证明了,含最高价元素的化合物,一定具有强氧化性
B.1mol还原剂反应时,转移的电子数为2NA
C.H2SO4在反应中表现了氧化性和酸性
D.可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒
难度: 中等查看答案及解析
-
有两支试管,分别装有Na2CO3和NaHCO3溶液,下列方案中判断正确的是( )
方案
操作
判断
A
分别滴加澄清石灰水
产生沉淀者为Na2CO3
B
分别加入过量等浓度、等体积的稀盐酸
反应较剧烈者为Na2CO3
C
分别加入CaCl2溶液
产生沉淀者为Na2CO3
D
分别逐滴加入等浓度的盐酸
立即产生气泡者为Na2CO3
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C.每生成16g氧气就有1mol Fe2+被还原
D.Na2FeO4既是还原产物又是氧化产物
难度: 中等查看答案及解析