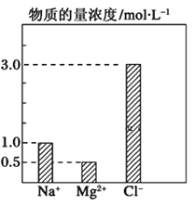
-
下列有关胶体的说法正确的是
A. 胶体是纯净物
B. 胶体与溶液的本质区别是有丁达尔效应
C. 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
D. 胶体属于介稳体系
难度: 简单查看答案及解析
-
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO4>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
难度: 中等查看答案及解析
-
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列的物质中,标签贴错了的是( )
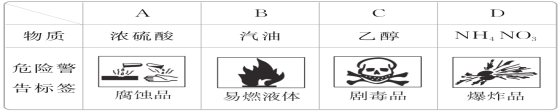
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
如图在盛有碘水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是
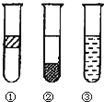
A.①加入的是CCl4,②加汽油,③加酒精
B.①加入的是酒精,②加CCl4,③加汽油
C.①加入的是汽油,②加酒精,③加CCl4
D.①加入的是汽油,②加CCl4,③加酒精
难度: 简单查看答案及解析
-
下列关于阿伏加德罗常数的说法中正确的是( )
A.6.02×1023叫做阿伏加德罗常数
B.12g碳含有的碳原子数就是阿伏加德罗常数
C.1mol 任何粒子的粒子数叫做阿伏加德罗常数
D.1摩尔氯含有6.02×1023个氯分子
难度: 中等查看答案及解析
-
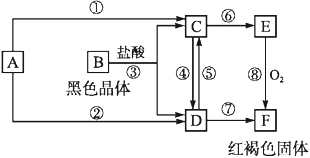
氮及其化合物的变化关系如图所示:
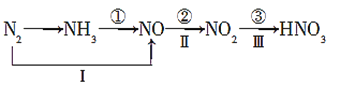
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.反应③中,NO2作氧化剂,H2O作还原剂
D.液氨可用作制冷剂,硝酸可用于制化肥、农药、炸药、染料、盐类等
难度: 中等查看答案及解析
-
欲配制1L含0.5mol NaCl、0.16mol KCl、0.24mol K2SO4的混合溶液,现用Na2SO4代替K2SO4来进行配制,则所需NaCl、KCl、Na2SO4三种固体的物质的量为( )
A.NaCl 0.32mol KCl 0.01mol Na2SO4 0.12mol
B.NaCl 0.02mol KCl 0.64mol Na2SO4 0.24mol
C.NaCl 0.66mol KCl 0.48mol Na2SO4 0.25mol
D.NaCl 0.50mol KCl 0.16mol Na2SO4 0.24mol
难度: 简单查看答案及解析
-
在容量瓶的使用方法中,下列操作中正确的是( )
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm 处,再用胶头滴管滴加蒸馏水到刻度线
D.浓硫酸稀释后,应马上转移到容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
难度: 简单查看答案及解析
-
下列关于气体摩尔体积的说法中正确的是
A.标准状况下,1 mol 水的体积是22.4 L
B.22 g 二氧化碳的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L·mol-1,其他条件下一定不是该值
D.标准状况下,1 mol任何气体的体积都约是22.4 L
难度: 简单查看答案及解析
-
下列化学反应的离子方程式错误的是( )
A.BaCl2溶液与K2SO4溶液的反应:Ba2++SO42—=BaSO4↓
B.NaOH溶液与硝酸的反应:OH-+H+=H2O
C.Na2CO3溶液与硫酸的反应:CO32—+2H+=CO2↑+H2O
D.碳酸钙与盐酸的反应:CO32—+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
对电解质概念的理解正确的是( )
A.水溶液里或熔融状态下能导电的物质
B.在水溶液里和熔融状态下都能导电的化合物
C.CaO溶于水能导电,但溶液中的离子是它与水反应生成的Ca(OH)2电离产生的,所以CaO是非电解质
D.在水溶液里或熔融状态下本身能电离出阳离子和阴离子而能导电的化合物
难度: 中等查看答案及解析
-
下列各项所述的关系正确的是( )
A.有电子转移是氧化还原反应的实质,有元素化合价的变化是氧化还原反应的外观表现
B.一种物质被氧化,必然有另一种物质被还原
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子对偏离
D.氧化反应就是得到电子或电子对偏向的反应,还原反应就是失去电子或电子对偏离的反应
难度: 简单查看答案及解析
-
下列氧化还原反应中,电子得失情况表示不正确的是
A.
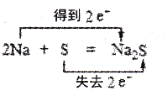 B.
B.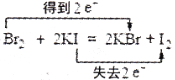
C.
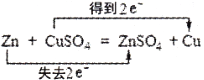 D.
D.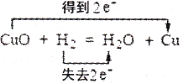
难度: 简单查看答案及解析
-
等物质的量的下列物质,分别与足量NaOH溶液反应,消耗NaOH的物质的量最多的是( )
A.Al2O3 B.KAl(SO4)2
C.Al(OH)3 D.Al
难度: 简单查看答案及解析
-
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①② B.①③ C.②③ D.①②③
难度: 中等查看答案及解析
-
下列判断正确的是( )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.可利用在空气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞试液中,最终溶液均为红色
难度: 中等查看答案及解析
-
关于Na2CO3和NaHCO3的说法正确的是( )
A.向两者的溶液中加入BaCl2均生成白色沉淀
B.向两者的溶液中逐滴加入HCl,反应现象完全相同
C.Na2CO3和NaHCO3两物质之间可以相互转化
D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象
难度: 中等查看答案及解析
-
下列有关Al与NaOH溶液反应的说法中,正确的是( )
A.铝是还原剂,其氧化产物是NaAlO2
B.NaOH是氧化剂,其还原产物是H2
C.Al是还原剂,H2O和NaOH都是氧化剂
D.水是氧化剂,铝被还原
难度: 简单查看答案及解析
-
下列说法中,错误的是( )
A.钠在空气中加热时,先熔化,再燃烧,燃烧所得产物为Na2O2
B.镁因在空气中形成一薄层致密的氧化膜保护了里面的镁,故镁不需要像钠一样作特殊保护
C.铝制品在生活中非常普遍,是因为铝不活泼
D.铁因在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属,故铁制品往往需要加保护层
难度: 中等查看答案及解析
-
歌曲《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然於碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大 多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
A. 可用氧化物形式表示为BaO•CuO•2SiO2 B. 性质稳定,不易脱色
C. x等于6 D. 易溶解于强酸和强碱
难度: 简单查看答案及解析
-
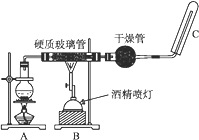
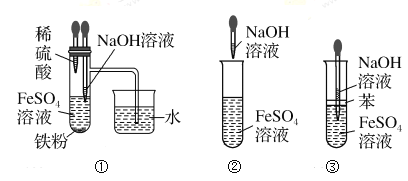
某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.二氧化硫能漂白某些物质,说明它具有氧化性
B.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色
C.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性
D.二氧化硫漂白过的草帽过一段时间后又会恢复到原来的颜色
难度: 中等查看答案及解析
-
某集气瓶内装的混合气体是红棕色,加入足量蒸馏水,盖上玻璃片振荡得橙黄色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,该混合气体可能是
A.N2、O2、Br2 B.NO2、NO、N2 C.NO2、NO、O2 D.N2、NO2、Br2
难度: 中等查看答案及解析
-
用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
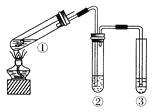
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
难度: 中等查看答案及解析
-
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
难度: 中等查看答案及解析