-
下列相关反应的离子方程式书写正确的是
A. 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ =Fe3++3H2O
B. 氯化铝溶液中滴加过量的氨水:Al3++4 NH3·H2O=AlO2-+4NH4++2H2O
C. NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+ NH3·H2O
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH- =BaCO3↓+2H2O+ CO32-
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列与化学有关的说法错误的是( )
A.水玻璃可作木材防腐剂和阻燃剂
B.用于3D打印材料的光敏树酯是纯净物
C.蒸馏法是常用的海水淡化的方法之一
D.碳酸钠可用于去除餐具的油污
难度: 中等查看答案及解析
-
下列过程中不涉及氧化还原反应的是( )
A.由植物油制备人造黄油
B.用氯化铁溶液腐蚀印刷线路板
C.用牺牲阳极的阴极保护法防止金属被腐蚀
D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体
难度: 简单查看答案及解析
-
下列关于物质的分类,正确的说法是( )
A.SiO2能分别与NaOH溶液、氢氟酸反应,所以SiO2为两性氧化物
B.油酸(C17H33COOH)与丙烯酸(CH2=CHCOOH)互为同系物
C.因为新制氯水含有3种分子,3种离子,所以氯水为混合物
D.NH3的水溶液能导电,所以NH3为电解质
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.1L水吸收标准状况下2.24LSO2,所得溶液的物质的量浓度为0.1mol·L-1
C.0.1mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
D.常温常压下,1.5molHCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
难度: 中等查看答案及解析
-
下列离子在给定的条件下一定能大量共存的是
A. 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3—
B. c(Fe3+)=0.1mol/L的溶液中:NH4+、AlO2—、SO42—、HCO3—
C. 水电离出的c(H+)=1×10—13mol/L的溶液中:Mg2+、K+、NO3—、Cl—
D. c(H+)=1×10—13mol/L的溶液中:K+、Cl—、AlO2—、CO32—
难度: 中等查看答案及解析
-
下列关于物质的鉴别或检验,说法正确的是( )
A.向 FeI2溶液通入少量Cl2,若溶液变为黄色,能证明还原性I- >Fe2+
B.向某溶液中滴加稀硫酸,只要产生有刺激性气味的气体,该气体能使品红溶液褪色,就可判断该溶液中存在SO32-
C.用 BaCl2溶液可以鉴别Na2CO3溶液和NaHCO3溶液
D.可用湿润的淀粉-KI试纸来鉴别NO2和溴蒸汽
难度: 中等查看答案及解析
-
某学习小组以废催化剂(主要成分SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。设计的实验方案如下:

下列说法正确的是
A. 步骤①中能溶于稀硫酸的是ZnO、ZnS和CuS
B. 步骤①、③中发生的反应均为氧化还原反应
C. 步骤③涉及的离子反应可能为CuS+H2O2+2H+
Cu2++S+2H2O
D. 步骤②和④,采用蒸发结晶,过滤后均可获取粗晶体
难度: 中等查看答案及解析
-
已知X、Y、Z、W四种物质存在如图转化关系,下列判断正确的是
A.若W是一种常见的金属单质,则X可能为
B.若W为强碱,Y为白色难溶于水的固体,则工业上可以电解X的水溶液来制取其中所含的金属
C.若W固体俗称干冰,则Y晶体中的阴、阳离子个数比为1∶1
D.若W是
,则Y一定是酸性氧化物
难度: 困难查看答案及解析
-
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3,若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分,下列说法正确的是
①一定含有HBr,可能含有CO2
②一定不含CO2
③一定不含NH3、Cl2
④可能含有Cl2、CO2
A.①和③ B.只有③ C.只有① D.②和③
难度: 简单查看答案及解析
-
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是
A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.储存1mol H2 时转移的电子为2mol D.此法储氢和钢瓶储氢的原理相同
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
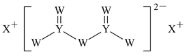
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
难度: 困难查看答案及解析
-
可逆反应:3N(s)
X(g)+2Y(g) ΔH<0在恒容绝热密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolX的同时生成3nmol N
②混合气体的平均相对分子质量不再改变
③气体X百分含量不再改变
④混合气体的密度不再改变的状态
⑤容器的压强不再改变
⑥容器温度不再改变
A.①⑤⑥ B.①②③④⑤⑥ C.①④⑤⑥ D.①②③⑤⑥
难度: 中等查看答案及解析
-
2017年春节期间,一种“本宝宝福禄双全”的有机物刷爆朋友圈,其结构简式如下,该物质的同分异构体中具有“本宝宝福禄双全”谐音且两个醛基位于苯环间位的有机物有( )
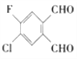
A. 4种 B. 6种 C. 7种 D. 9种
难度: 中等查看答案及解析
-
氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知H2O2足量,下列说法正确的是( )
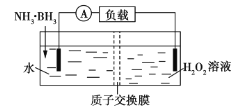
A.正极的电极反应式为2H++2e-=H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作足够长时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
难度: 中等查看答案及解析
-
常温下,用0.1 mol/L的氨水滴定10.00 mL 0.1 mol/L的酸HA,所加氨水的体积(V)与溶液中lg
的关系如图所示。下列说法错误的是
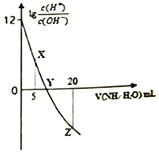
A.X点:c(A-)>c(H+)>c(NH4+)>c(OH-) B.Y点:V(NH3·H2O) <10.00 mL
C.Z点:2c(A-)= c(NH4+)+c(NH3·H2O) D.HA的电离方程式为HA=H++A-
难度: 中等查看答案及解析
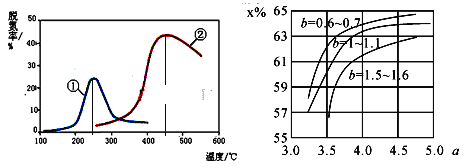
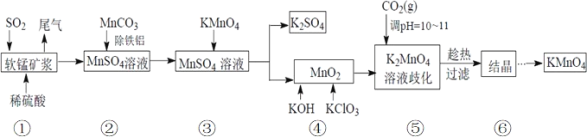 20℃时,相关物质的溶解度数据见下表:
20℃时,相关物质的溶解度数据见下表: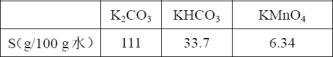
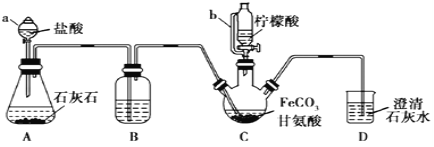
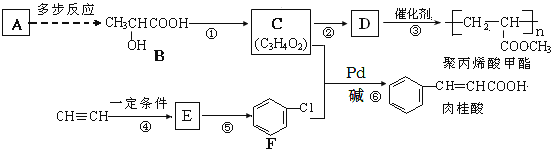
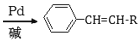 +HX (X为卤原子,R为取代基)
+HX (X为卤原子,R为取代基)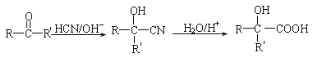 ,设设计由A(C2H4)制备B的合成路线(无机试剂任选):____________。
,设设计由A(C2H4)制备B的合成路线(无机试剂任选):____________。